前言
本资料是2019年秋季学期《环境纳米技术导论》的资料整理,主讲老师为刘文。按照课堂说明,期末考试仅涉及重要度为“1”“2”的部分,不涉及重要度为“3”“4”的部分,因此在修订过程中删去了期末考试不涉及的内容。<以全角尖引号包裹的斜体字>为课堂讲授但课件中没有标注的内容,(以全角圆括号包裹的斜体字)为课件中重要度为“3”“4”的部分或协助理解的内容。
课程简介
- 环境纳米实验室定位:科学 + 工程 +管理。
- 水体中有毒有害污染治理:国际水环境研究前沿领域、我国水环境治理重大国家需求。
- 探索环境功能纳米材料开发与应用的新途径:极佳的机遇、严峻的挑战。
- 研究内容:
- 环境功能材料的开发、合成与表征。
- 功能材料环境应用(污染物、过程)。
- 材料水环境行为和毒理。
第1讲 环境纳米材料绪论
1.1. 纳米材料与环境
- 环境纳米技术:
- 纳米材料:
- 纳米材料合成:物理、化学、生物合成。
- 纳米材料表征:表征仪器原理及方法。
- 环境应用:
- 环境纳米修复技术:吸附技术、光催化技术、非均相催化技术、膜技术(纳滤)。
- 环境纳米监测技术:纳米传感器、环境介质监测。
- 纳米材料环境行为与毒理:团聚沉降、迁移转化、毒理与生态效应。
- 纳米材料:
- 环境纳米修复技术:
- 常见纳米材料:钛系(Ti,包括TiO2、钛酸盐等)、碳系(C)、常规金属系(Fe、Al、Mn)、有机高分子系(MOFs)。
- 修复方法:化学法、物化法、生物法。
- 重金属:非降解去除(固定)、形态转化(降毒)。
- 有机物:高去除率和矿化率、低成本和低能耗。
- 优势:
- 性质稳定、结构组成均一。
- 反应活性高、动力学过程快。
- 工艺简单、易于操作、环境友好。
- 作用方式:
- 吸附(位点丰富,比表面积大)。
- 光催化(优异的光响应)。
- 非均相催化(结构均一、活性高)。
1.2. 尺度
- 纳米科学的基本概念:
- 纳米科学与技术实际上就是在原子层次上认识世界。
- 纳米是长度单位,1 nm = 10-9 m = 10 Å。氢原子的直径约为1 Å。
- 1990年,美国IBM公司用STM移动氙原子在镍金属表面组成了“IBM”三个字母。
- 纳米材料的环境应用:
- 最常用的纳米材料——TiO2:化妆品、塑料、油漆等。
- 新兴污染物的环境效应尚不明晰。
- 科技革命的尺度标志:
- 第一次工业革命:毫米时代。
- 第二次工业革命:微米时代。
- 第三次工业革命:纳米时代。
第2讲 环境纳米材料原理与基本概念
2.1. 纳米材料的定义与分类
- 材料科学的发展:材料与文化息息相关。社会的发展和进步取决于可以获得并使用的材料。
- 纳米科技:
- 在纳米尺度(1 ~ 100 nm)上研究物质的特性和相互作用,以及利用这些特性的科学和技术。
- 1974年,谷口最早用“纳米技术”描述精细机械加工。
- 纳米技术是一门前沿应用科学,其目的在于研究在纳米尺寸下物质和设备的设计方法、组成、特性以及应用。
- 美国国家纳米科技启动计划(NII)将其定义为“1 ~ 100 nm尺寸见的物体,其中能有重大应用的独特现象的了解与操纵”。
- 纳米材料:
- 一般称三维空间中至少有一维处于纳米尺度(100 nm)的材料为纳米材料,也包括以它们为基元构成的块体材料。
- 根据空间中未被纳米约束的自由度(电子运动的维度),纳米材料可分为四类:
- 习惯上 ,又把0D、1D、2D纳米材料统称为低维纳米材料。
- 量子点:把导带电子、价带空穴、激子在三个空间方向上束缚住的半导体纳米结构。电子运动在三维空间都受到了限制。
- 量子点是由有限数目的原子(原子团簇)组成,三个维度尺寸均在纳米数量级。量子点一般为球形或类球形,是由半导体材料制成的、稳定直径在2 ~ 20 nm的纳米粒子。
- 量子点是在纳米尺度上的原子和分子的集合体。可由一种半导体材料组成,也可由两种或以上的材料组成。
- 纳米材料的三个特征:
- 广义定义:材料的基本单元至少有一维的尺寸在1 ~ 100 nm范围内。
- 同时具备的两个基本特征:纳米尺度和性能的特异变化。
- 设计过程必须体现微观操控的能力,即能够从根本上左右分子尺度的结构的物理性质与化学性质。
- 能够组合起来形成更大结构且具有优异的电气、化学、机械与光学性能。
2.2. 纳米效应
- 量子尺寸效应:
- 费米能级:温度为绝对零度时固体能带中充满电子的最高能级。(金属内的电子因泡利不相容原理不能每个电子都在最低的能级,一个个依序向高能级填充的最后一个能填进的能级即为费米能级。)
- 金属费米能级附近电子能级在高温或宏观尺寸下是连续的。当粒子尺寸下降到接近或小于某一值(激子波尔半径),费米能级附近的电子能级由准连续变为分立能级。
- (能带:n个原子集聚形成晶体时,孤立原子的一个能级分裂成n个能级,n的数目非常大时能级间距非常小,认为这n个能级形成能量准连续的区域,称为能带。)
- (禁带、导带、价带:当原子间距接近原子间的平衡距离时,该能带再次分裂为两个能带。两个能带之间的没有可能的电子态的区域,称为禁带。可以认为来源于孤立原子不同原子轨道之间的能隙。在禁带上方的能带叫导带,下方的能带叫价带。见)
- 根据导带和价带之间的距离,将材料区分为绝缘体、半导体和导体。
- 前线轨道理论:分子中最高被占据分子轨道(HOMO)上的电子能量最高,受束缚最小,最活泼;最低未被占据分子轨道(LUMO)在所有未占轨道中能量最低,最容易接受电子。这两个轨道决定分子的电子得失和转移能力。
- <应用:硝基酚,计算每个位点得失电子能力,得出亲电自由基/亲核自由基攻击的位点;硝基氮易于得电子被还原。>
 |
 |
- 小尺寸效应:
- 当超细微粒的尺寸与光波波长、德布罗意波长、超导态的相干长度等物理特征尺寸相当或更小时,晶体周期性的边界条件被破坏,非晶态纳米微粒的颗粒表面层附近密度减小,导致声、光、电、磁、热、力学等特性呈现新的小尺寸效应。
- 实例:
- 光吸收显著增加,并产生吸收峰的等离子共振频移。
- 磁有序态向磁无序态、超导相向正常转变。
- 声子谱发生改变。
- 表面效应:
- 随着粒径减小,纳米粒子的比表面积、表面能都迅速增加,表面原子周围缺少相邻的原子,有许多悬空键,出现不饱和性质,具有很高的化学活性。
- 宏观量子隧道效应:
- 微观粒子具有贯穿势垒的能力称为隧道效应。一些宏观量(例如粒子的磁化强度、量子相干器件中的磁通量等)亦具有隧道效应,称为宏观量子隧道效应。
- 应用:扫描隧道显微镜(STM)。
2.3. 纳米科学和材料的研究历程与理念
- 纳米技术发展历程:<来源:美国EPA白皮书。>
- 第一代,~ 2001:惰性纳米材料。纳米结构涂料,纳米粒子,纳米结构金属,聚合物,陶瓷,催化剂,复合材料,显示器。
- 第二代,~ 2005:活性纳米材料。晶体管,放大器,靶向药和化学品,执行器,自适应结构,传感器,诊断分析,燃料电池,太阳能电池,高性能纳米复合材料,陶瓷,金属。
- 第三代,~ 2010:3D纳米系统。各种组装技术,纳米级网络和新架构。仿生材料,新型疗法/靶向药物递送。
- 第四代,~ 2015:分子纳米系统。分子装置设计,原子设计,新兴功能。
- 纳米技术的研究历程:
- 聚焦:材料尺寸从微纳米尺度减小至纳米尺度,与此同时研究材料的小尺寸效应。
- 放大:以零维、一维、二维等低维材料作为结构单元构建微观尺寸的分级结构材料,进而讨论材料的微纳米协同效应。
- 自然界中有很多微/纳米分级结构的例子,如蝴蝶翅膀、壁虎脚、荷叶、蜘蛛丝、肾小球膜、犰狳壳等。这些纳米材料显示出优异的摩擦、粘附、润湿、增透、过滤、增韧等性能。

- 纳米技术的哲学理念——架构:
- 从上而下:是指通过微加工或固态技术,不断在尺寸上将人类创造的功能产品微型化。<自上而下的思想导致了资源利用的不充分,从而导致了废弃物的产生。>
- 自下而上:是指以原子、分子为基本单元,根据人们的意志进行设计和组装,从而构筑成具有特定功能的产品。
- STM的原理:隧道效应。其探针和被研究物质表面作为两个电极,当样品与针尖的距离非常接近时(小于1 nm),在外加电场作用下电子穿过势垒流向另一电极,在探针和样品间产生微弱电流(隧道电流)。
- <STM写字:通过改变针尖的材质及其与原子之间的作用力来实现。>
2.4. 纳米材料应用
- 身边的纳米技术:
- 荷叶的自清洁效应:荷叶表面暴露出疏水性基团,洒在叶面上的水会自动聚集成水珠。水珠的滚动把落在叶面上的尘土污泥粘吸滚出叶面。
- 蝴蝶翅膀上的斑斓色彩:蝴蝶翅膀上具有微纳结构,能够捕捉光线,仅让某种波长的光线透过。
- 纳米活性组分:单原子催化剂,在加氢、CO氧化、甲烷转化、氧还原等反应中单原子均表现出优异的活性以及选择性。如铜原子催化剂。
2.5. 纳米材料的研究
- 纳米科技的研究领域:
- 纳米材料开发:纳米结构材料、纳米功能材料(环境功能纳米材料)、纳米催化剂、清洁剂、助燃剂等。
- 纳米器件。
- 纳米区域的探测、研究与表征分析。
- 美国:国家纳米技术计划(NNI),2001年实施,希望从纳米尺度上理解和控制物质。
- 中国:
- 科技部于2001年发布《国家纳米科技发展纲要(2001-2010)》。关键技术:
- 纳米材料制备与加工技术:低成本、环境友好、高稳定性。
- 纳米器件的构筑和集成技术:原子操纵技术、自生长自组装技术。
- 纳加工技术。
- 纳米尺度的结构分析和性能测试技术:纳米尺度探测技术。
- 装备技术。
- 国家安全。
- “纳米科技”重点专项:
- 总体目标:获得重大原始创新和重要应用成果,提高自主创新能力及研究成果的国际影响力,力争在若干优势领域率先取得重大突破。
- 研究任务:新型纳米制备与加工技术;纳米表征与标准;纳米生物医药;纳米信息材料与器件;能源纳米材料与技术;环境纳米材料与技术;纳米科学重大基础问题。
- 科技部于2001年发布《国家纳米科技发展纲要(2001-2010)》。关键技术:
- 纳米材料的环境行为:废水处理是纳米材料的重要源和汇。<纳米材料进入污水管道被收集,流入污水处理厂;污水处理厂无法降解的纳米材料会随着已处理的水流入自然界。>
2.6. 期刊
- 影响因子(IF):IF = 前1年的引用数 / 前2 ~ 3年的文章数。例:IF(2015) = 2015年的引用数 / 2013 ~ 2014年的文章数。
- 外文期刊影响因子检索:JCR数据库。
- 科学引文索引(SCI):美国科学情报研究所出版的期刊文献检索工具。
- 中科院JCR期刊分区:是根据JCR中SCI期刊在学科内3年平均影响因子划分分区。前5%一区,5% ~ 25%二区,25% ~ 50%三区,其余四区。
- 其他重要索引和目录:工程索引(EI)、北京大学中文核心期刊目录。
第3讲 纳米材料的制备与表征
3.1. 总论
3.2. 纳米材料制备的物理方法
3.2.1. 机械粉碎法
- 定义:固体物料粒子尺寸由大变小过程的总称,它包括“破碎”和“粉磨”。前者是由大料块变成小料块的过程,后者是由小料块变成粉体的过程。
- 基本粉碎方式:压碎、剪碎、冲击粉碎和磨碎。
- 原理:
- 颗粒之间或颗粒与磨球之间互相摩擦,使得一定粒度范围内的颗粒造成表面粉碎,结果形成大和小两种粒度的新颗粒,称为摩擦粉碎或表面粉碎。
- 由于球对颗粒或颗粒对颗粒的冲击、碰撞和剪切等作用,从颗粒中近似等体积地分割出两个小颗粒,称为冲击压缩粉碎或体积粉碎。
- 逆粉碎现象:物料在超细粉碎过程中,随着粉碎时间的延长,颗粒粒度的减小,比表面积的增加,颗粒的表面能增大,颗粒之间的相互作用增强,团聚现象增加,达到一定时间后,颗粒的粉碎与团聚达到平衡。
- 是各种粉碎存在最低粒度下限的主要原因。是相似条件下湿法球磨比干法粒度下限低的原因。
- <湿法中,水会促进颗粒的分散,因此湿法比干法粒度下限低。>
- DLVO理论:研究带电胶粒和悬浮粒子稳定性的经典理论。
- 缺点:
- 安全性问题:对于易燃、易爆物料,其粉碎生产过程中还会伴随有燃烧、爆炸的可能性。
- 纳米机械粉碎极限:在纳米粉碎中,随着粒子粒径的减小,被粉碎物料的结晶均匀性增加,粒子强度增大,断裂能提高,粉碎所需的机械应力也大大增加。因而粒度越细,粉碎的难度就越大。粉碎到一定程度后,尽管继续施加机械应力,粉体物料的粒度不再继续减小或减小的速率相当缓慢,这就是物料的粉碎极限。
- 球磨法:生产纳米粉体材料的有效方法。球磨实验通常运行在圆柱形的不锈钢容器和小球之间。
- 在球磨过程中可以选择不同的球磨气氛,诸如氢气、氧气、空气、氮气、氩气或真空。为了较好地控制粉的物性,也可以选择不同的球磨机,不同的球磨机所制备的粉的性能也不同。
- 控制适当的条件得到纯元素、合金或复合材料的纳米粒子。
- 球磨法已被广泛应用于制备SnO2、钛铁矿、TiO2纳米材料、纳米矿物材料和MoO3/C复合纳米材料等。
3.2.2. 物理气相沉积法
- 物理气相沉积法(PVD):是一种典型的采用物理方法制备纳米粉体的方法。其中没有化学反应产生,其主要过程是固体材料的蒸发和蒸发蒸气的冷凝或沉积。
- 1963年,上田良二提出。通过材料在纯净的惰性气体中的蒸发和冷凝过程获得较干净的纳米微粒。气体冷凝法是在低压的氦、氩等惰性气体中加热金属、合金或陶瓷使其蒸发气化,然后与惰性气体碰撞冷凝形成超微粒(1 ~ 1000 nm)或纳米微粒(1 ~ 100 nm)。
- 加热的方法:电阻加热、等离子体、高频感应、电子束、激光加热等。
- 还有一种常用的物理气相沉积法为溅射法。
- 等离子体:又叫做电浆,是由部分电子被剥夺后的原子及原子团被电离后产生的正负离子组成的离子化气体状物质,尺度大于德拜长度的宏观电中性电离气体,其运动主要受电磁力支配,并表现出显著的集体行为。
- 原理:整个过程是在超高真空室内进行。通过分子涡轮使其达到0.1 Pa以上的真空度,然后充入低压(约2 kPa)的纯净惰性气体(He或Ar,纯度约为99.9996%)。欲蒸的物质(例如:金属、CaF2、NaCl、FeF等离子化合物、过渡族金属氮化物及易升华的氧化物等)置于坩埚内,通过钨电阻加热器或石墨加热器等加热装置逐渐加热蒸发,产生原物质烟雾,由于惰性气体的对流,烟雾向上移动,并接近充液氮的冷却棒(冷阱,77 K)。
- 溅射法:用两块金属板分别作为阳极和阴极,阴极为蒸发用的材料,在两电极间充入Ar气(40 ~ 250 Pa),两电极间施加的电压范围为0.3 ~ 1.5 kV。由于两电极间的辉光放电使Ar离子形成,在电场的作用下Ar离子冲击阴极靶材表面(加热靶材),使靶材原子从其表面蒸发出来形成超微粒子,并在附着面上沉积下来。
3.3. 纳米材料制备的化学方法
3.3.1. 化学气相沉积法
- 化学气相沉积法(CVD):在远高于临界反应温度的条件下,通过化学反应,使反应产物蒸气形成很高的过饱和蒸气压,自动凝聚形成大量的晶核,这些晶核不断长大,聚集成颗粒,随着气流进入低温区,最终在收集室内得到纳米粉体。
- 纳米晶体生长机理:气-固转化晶体生长的过程可以归结为几个最重要的步骤:
- 原子或分子撞击到生长表面上。
- 被吸附或被反射回气相。
- 被吸附物之间发生表面反应形成成晶粒子。
- 通过二维扩散迁移到适当晶格位置上并进入晶格。
3.3.2. 化学沉淀法
- 化学沉淀法:包含一种或多种离子的可溶性盐溶液,当加入沉淀剂(如OH-、C2O42-、CO32-等)后,或于一定温度下使溶液发生水解,形成不溶性的氢氧化物成效类从溶液中析出,并将溶液中原有的阴离子洗去,经热分解即得到所得的氧化物粉料。
- 特点:简单易行,但纯度低,颗粒半径大,适合制备氧化物等。
- 共沉淀法:含多种阳离子的溶液中加入沉淀剂后,所有离子完全沉淀的方法。它又可分成单相共沉淀和混合物的共沉淀。
- 单相共沉淀:沉淀物为单一化合物或单相固溶体时,称为单相共沉淀。
- 混合物共沉淀:如果沉淀产物为混合物时,称为混合物共沉淀。
- 金属醇盐水解法:利用一些金属有机醇盐能溶于有机溶剂并可能发生水解,生成氢氧化物或氧化物沉淀的特性,制备细粉料的一种方法。
- 特点:可以得到高纯度的氧化物粉体;可制备化学计量的复合金属氧化物粉末。
3.3.3. 水热法
- 水热法:水热反应是高温高压下在水(水溶液)或蒸汽等流体中进行有关化学反应的总称。水热法在高压釜里的高温、高压反应环境中,采用水作为反应介质,使得通常难溶或不溶的物质溶解,反应还可进行重结晶。
- 特点:
- 相对低的温度和温和的反应条件。
- 在封闭容器中进行,避免了组分挥发。
- 与一般湿化学法相比较,水热法可直接得到分散且结晶良好的粉体,不需作高温灼烧处理,避免了可能形成的粉体硬团聚。
3.4. 纳米材料制备的物化方法
3.4.1. 溶胶凝胶法
- 溶胶凝胶法:将金属醇盐或无机盐水解,然后使溶质聚合凝胶化,再将凝胶干燥、煅烧,最后得到无机纳米材料。
- 反应过程:
- 溶胶的制备:
- 一种方法是先将部分或全部组分用适当沉淀剂先沉淀出来,经解凝,使原来团聚的沉淀颗粒分散成原始颗粒,这种原始颗粒的大小一般在溶胶体系中胶核的大小范围,因而可制得溶胶。
- 另一种方法是由同样的盐溶液出发,通过对沉淀过程的仔细控制,使首先形成的颗粒不致团聚为大颗粒而沉淀,从而直接得到溶胶。
- 溶胶-凝胶转化:溶胶中含大量的水,凝胶化过程中,使体系失去流动性,形成一种开放的骨架结构。实现胶凝作用的途径有两个:一是化学法,通过控制溶胶中的电解质浓度来实现胶凝化;二是物理法,迫使胶粒间相互靠近,克服斥力,实现胶凝化。
- 凝胶干燥:在一定条件下(如加热)使溶剂蒸发,得到粉料。干燥过程中凝胶结构变化很大。
- 溶胶的制备:
- 软化学合成法的代表:由于溶胶-凝胶法可以大大降低合成温度。用无机盐作原料,价格相对便宜。溶胶-凝胶法广泛应用于金属氧化物纳米粒子的制备。前驱物用金属醇盐或非醇盐均可。方法实质是前驱物在一定条件下水解成溶胶,再制成凝胶,经干燥纳米材料热处理后制得所需纳米粒子。
- 软化学合成法:在比较温和的反应条件下,进行化学合成的一系列方法,在纳米材料的制备领域中应用较多。纳米材料因为处于介稳状态,一般不宜通过激烈的反应条件制备。常见的软化学方法包括溶胶-凝胶法、水热法、微乳液法、低温固相法、气相沉积法、前驱体法、微波辅助合成等。
3.4.2. 微乳液法
- 微乳液法:采用微乳液来制备纳米材料的方法。微乳液为两种互不相溶的液相,一相以微液滴形式(直径约为1 ~ 200 nm)分散在另一相中所形成的分散体系。
3.4.3. 模板法
- 模板法:将具有纳米结构、形状容易控制、价廉易得的物质作为模板,通过物理或化学的方法将相关材料沉积到模板的孔中或表面而后移去模板,得到具有模板规范形貌与尺寸的纳米材料的过程。
- 模板法是合成纳米复合材料的一种重要方法,也是纳米材料研究中应用广泛的方法,特别是制备性能和形貌特异的纳米材料,模板法可以根据合成材料的性能要求以及形貌来设计模板的材料和结构,来满足实际的需要。
- 模板合成技术便是化学家们找到的“窍门”。模板合成的原理实际上非常简单。设想存在一个纳米尺寸的笼子(纳米尺寸的反应器),让原子的成核和生长在该“纳米反应器”中进行。在反应充分进行后,“纳米反应器”的大小和形状就决定了作为产物的纳米材料的尺寸和形状。无数多个“纳米反应器”的集合就是模板合成技术中的“模板”。问题是如何找到、设计和合成各种模板?
- 分类:软模板和硬模板。
- 软模板:常常是由表面活性剂分子聚集而成的胶团、反胶团、囊泡等。
- 硬模板:多孔氧化铝、介孔沸石、蛋白、MCM-41、纳米管、多孔Si模板、金属模板以及经过特殊处理的多孔高分子薄膜等。
- 举例:制备多孔氧化铝(AAO)四个步骤:退火预处理;脱脂和去氧化层的清洗处理;电抛光处理;阳极氧化。
- 二者的共性是都能提供一个有限大小的反应空间,区别在于后者提供的是静态的孔道,物质只能从开口处进入孔道内部,而前者提供的则是处于动态平衡的空腔,物质可以透过腔壁扩散进出。
第4讲 纳米材料的表征
4.1. 材料分析基础理论
- 表征的出发点——纳米材料的组成和结构鉴定。
- 纳米材料由原子和分子组合而成。
- 纳米材料的化学组成:组成材料最基本、独立的物质,可以是纯元素或稳定的化合物,以及其种类和数量。
- 纳米材料的相组成:材料中具有同一化学成分并且结构相同的均匀部分称为相,组成材料的相的种类和数量称为相组成。可分为单相材料、多相材料。如纯金属是单相材料,钢在室温下由铁素体(含碳的α-Fe)和渗碳体(Fe3C)组成。
- 纳米材料的形貌:材料内部的微观形貌,是指各种相或晶粒形成的图案,尤其是在纳米尺度上的可视化表现。
- 纳米材料——化学组成:
- 金属纳米材料的化学组成。
- 无机非金属纳米材料的化学组成。
- 高分子纳米材料的化学组成。
- 复合纳米材料的化学组成。
- 环境纳米材料系列:钛系(Ti)、碳系(C)、常规金属系(Fe、Al、Mn)、有机高分子系(MOFs)。
- 纳米材料——结构:
- 定义:指材料的组成单元(原子或分子)之间相互吸引和排斥作用达到平衡时的空间排布,即稳定状态下的排布方式。
- 性能与结构的关系:材料的性能依赖于材料的结构。在材料的组成单元中,各个原子通过化学键结合在一起。因此,不同材料的性能差异本质上是由不同的元素以不同的键合方式造成的。
- 实例:碳纳米材料的结构。
- 结构组成原理——纳米材料中的化学键合:
- 金属键:外层电子公有化,自由电子构成的键。
- 离子键:正负离子间的静电引力形成的键。
- 共价键:原子结合形成分子的键。
- 分子键(或范德华键)。
- 氢键。
- 一般在多元化合物中,总是具有几种键型。例如,纳米钛酸盐是包含多种键型的复杂化合物,存在大量的离子键([Ti-O6])和共价键(O-H),同时也有氢键。
- 特定的结构组成——晶体结构:
- 晶体:是指原子或原子团、离子和分子按一定规律呈周期性的排列构成的物质。
- 晶体周期性:是原子或分子在三维空间呈周期性的规则而有序地排列,即存在长程的几何有序。
- 空间点阵:由几何点沿空间三个不共面的方向按一定距离形成的有规则三维点阵。
- 晶体的对称性:晶体经过某种几何变化仍能恢复原状的特性,对称要素为平移面和对称轴。
- 从结构上看,晶体的排列状态是由构成原子或分子的几何形状和键型所决定。
- 晶体结构的基本特征:
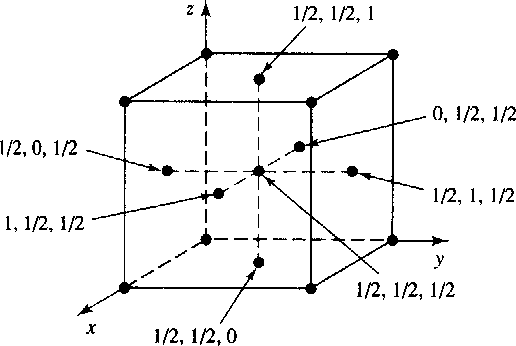
- 任取一点作为坐标原点,在空间三个方向上选取重复周期矢量a,b,c称为基本矢量,三个方向轴称为晶轴。由基本矢量构成的平行六面体称为单位晶胞。单位晶胞在三个方向上重复即可建立整个空间点阵。
- 对于同一点阵,只有一种最理想的单位晶胞。其选择依据是:最能反映出点阵对称性、基本矢量长度a,b,c相等的数目最多,三个方向的夹角α,β,γ尽可能为直角,单胞体积最小。根据以上条件选择出来的晶胞,其几何关系、计算公式最简单,称为布拉维晶胞。(见)
- 按照点阵的对称性,将自然界的晶体划分为7个晶系。每个晶系最多包含4种点阵。如果晶胞的角上有结点,可归为简单点阵;如果晶胞的体心、底心和面心有结点,可归为复杂点阵。布拉维于1948年用数学方法证明了空间点阵共有14种,而且只有14种布拉维点阵。(见)
| 晶系(7种) | 布拉维晶格(14种) | ||||
|---|---|---|---|---|---|
| 简单(P) | 体心(I) | 底心(C) | 面心(F) | ||
| 三斜晶系 | |||||
| 单斜晶系 | |||||
| 斜方晶系 (正交晶系) |
|||||
| 四方晶系 (正方晶系) |
|||||
| 三方晶系 (菱方晶系) |
|||||
| 六方晶系 | |||||
| 等轴晶系 (立方晶系) |
|||||
 |
 |
 |
- 晶体结构的参数:结点、晶向指数、晶面指数。
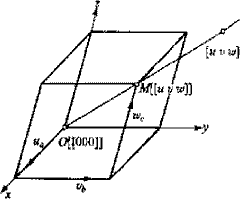
- 晶向指数[uvw]的确定方法:
- 建立坐标系,即以任阵点位坐标原点,以晶轴为坐标轴,并以点阵基本矢量\(\vec a\),\(\vec b\),\(\vec c\)分别为相应坐标轴单位矢量。
- 通过原点引一条直线,使其平行于待标志的晶相。
- 选取该直线上任意一点的坐标。
- 将三个坐标值按比例化为最小整数,即所求的晶向指数[uvw]。坐标值为负数时,则在相应指数上加上-号。
- 晶面指数(hkl)的确定方法:
- 建立坐标系。
- 求出待标志晶面在3个坐标轴上的截距(若晶面与坐标轴平行,则截距为∞),此截距的大小分别以三个基本矢量长度为单位。
- 取3个截距值的倒数,将其按比例化为最小整数,即所求的晶面指数(hkl)。
- 晶体缺陷:
- 实际上,组成材料的晶体中的原子总是在平衡位置附近进行热振动。其原子或离子的排列不可能是完全规则的,即存在着晶体缺陷。即大多数晶体与理想晶体结构都有一定偏差存在。
- 晶体结构的不完整性对其性能有重大影响。
- 不完整性按照其几何形状分为:点缺陷、线缺陷、面缺陷。
- 金属纳米材料结构:金属材料可以看成由晶体的聚集体构成。金属晶体的结构随温度变化会发生变体转变。
- 高分子纳米材料的结构:链结构、交联网状结构、聚集态结构。
- <石墨烯纤维&碳纳米管:石墨烯平面卷起来组成管状变成了碳纳米管,多个管状就是多壁碳纳米管,螺旋圈起来叫做石墨烯纤维。>
- 纳米材料分析测试的地位与作用:
- 材料的使用依赖于材料的性能,而其性能都是由其组成和结构决定的。
- 只有从微观上了解材料的组成、结构与性能的关系,才能有效地选择制备和使用材料。
- 纳米材料研究的四要素:成分、结构、制备、性能。
- 纳米材料分析的意义:
- 纳米材料表征:获得纳米材料的特征信息。
- 主要从纳米材料的成分分析、形貌分析、粒度分析、结构分析以及表面界面分析等几个方面进行了简单的介绍。
- 纳米材料的光电声热磁等物理化学性能与组成纳米材料的化学成分和结构具有密切关系。
- 因此确定纳米材料的元素组成测定纳米材料中杂质的种类和浓度是纳米材料分析的重要内容之一。
- 表征:鉴定化学成分的主要技术。
- 化学分析:重量分析、滴定分析等。
- 电化学分析:电导、电位等。
- 光谱技术:原子发射光谱、原子吸收光谱、原子荧光光谱等。
- 色谱分析:气相色谱、液相色谱、离子色谱、薄层色谱、毛细管电泳等。
- 波谱分析:红外光谱、紫外光谱、核磁共振、质谱等。
- 能谱分析:X射线光电子能谱、俄歇电子能谱、电子探针能谱仪等。
- 衍射技术:电子衍射、中子衍射和X射线衍射等。
- 显微技术:光学显微镜、电子显微镜(透射电子显微镜、扫描电子显微镜)、扫描隧道电镜、原子力显微镜。
- 热分析技术:差热分析、热重分析、扫描量热分析等。
- 物理性质测试技术:密度、硬度、粒径、导电、强度、孔结构、比表面积等。
- 按测试原理分类:
- 光谱分析:原子发射光谱AES、原子吸收光谱AAS、原子荧光光谱AFS、分子吸收光谱MAS(紫外-可见分光光度法UV-Vis、红外光谱法IR、拉曼光谱法RS)。
- 显微分析:透射电子显微镜TEM、扫描电子显微镜SEM、扫描隧道显微镜STM、原子力显微镜AFM、离子探针IMA。
- 能谱分析:X射线光电子能谱XPS、能量色散X射线谱EDS、背散射能谱分析RBS。
- 其他重要分析手段:X射线衍射XRD、元素分析EA、热重分析TGA、比表面积测定BET、粒径分布、孔结构分析。
- 北京大学分析测试中心:http://aic.pku.edu.cn/。
4.2. 材料分析方法
4.2.1. 显微分析法
- 显微分析法:显微分析是人类认识微观世界必不可少的工具。利用显微镜,人们甚至可以看到单个原子(小于10-10 m)。
- 几个重要的分辨率:人眼0.2 mm,光学显微镜0.2 μm,电子显微镜0.2 nm。
- 光学显微镜:可见光作为照明源,用透镜来聚光和放大图像。
- 电子显微分析:使用高能量的电子代替光作为照明源,使用电磁线圈代替玻璃透镜来聚集成像,分辨率可高达0.2 nm。
- 电镜成像原理:
- 透射电镜(TEM)成像:直接透射的电子,以及弹性或非弹性散射的透射电子,用于透射电镜的成像。——电子束打穿成像。
- 扫描电镜(SEM)成像:如果入射电子撞击样品表面原子的外层电子,所产生的二次电子、背散射电子和少部分X射线共同用于扫描电镜的成像。——像素极高的照相机。
- 透射电子显微镜(TEM):
- 样品测试过程:抽真空 → 上样品 → 观察 → 拍照 → 取样。
- 表征信息:材料的形貌,组织结构,尺寸分布,微区元素分析(能量色散X射线谱EDS),选区晶体结构分析(选区电子衍射SAED)。
- 扫描电子显微镜(SEM):
- 是利用细聚焦电子束在样品表面逐点扫描,与样品相互作用产生各种物理信号,这些信号经检测器接收、放大并转换成调制信号,最后在荧光屏上显示反映样品表面各种特征的图像。
- 扫描电镜的工作原理可以简单地归纳为“光栅扫描,逐点成像”。
- 特点:
- 高的分辨率。其水平和垂直分辨率可以分别达到0.1 nm和0.01 nm,可以直接观察到材料表面的单个原子和原子在材料表面的三维结构图。
- 有较高的放大倍数,20 ~ 20万倍之间连续可调。
- 有很大的景深,视野大,成像富有立体感,可直接观察各种试样凹凸不平表面的细微结构。
- 试样制备简单。样品通常不需要作任何处理即可以直接进行观察,所以不会由于制样原因而产生假象。
- 结构简单,其实验可以在多种环境中进行:如大气、超高真空或液体,且工作温度范围较宽,可以从绝对零度到上千摄氏度。
- 在观测材料表面结构的同时,可得到材料表面的扫描隧道谱,从而可以研究材料的表面化学结构和电子状态。
- 只能观察导体或半导体材料的表面结构,无法观察绝缘体表面形貌。
- 样品制备:
- 方法简单,对金属和陶瓷等块状样品,只需将它们切割成大小合适的尺寸,用导电胶将其粘接在电镜的样品座上即可直接进行观察。
- 对于非导电样品如塑料、矿物等,在电子束作用下会产生电荷堆积,影响入射电子束斑和样品发射的二次电子运动轨迹,使图像质量下降。因此这类试样在观察前要喷镀导电层进行处理,通常采用二次电子发射系数较高的金银或碳膜做导电层,膜厚控制在20 nm左右。
- 表征信息:材料的形貌,微区成分特性、定量分析。
- <元素分析:电子束在试样表面扫描时,元素在试样表面的分布能在屏幕上以亮度(或彩色)分布显示出来,亮度越亮说明元素含量越高。研究材料中杂质、相的分布和元素偏析常用此方法。>
- 隧道电流强度对针尖和样品之间的距离有着指数依赖关系,根据隧道电流的变化,我们可以得到样品表面微小的起伏变化信息,如果同时对x-y方向进行扫描,就可以直接得到三维的样品表面形貌图,这就是扫描隧道显微镜的工作原理。
- 与光学显微镜和电子显微镜不同,扫描电镜不采用任何光子或电子透镜成像,而是当尖锐金属探针在样品表面扫描时,利用针尖-样品间纳米间隙的量子隧道效应引起隧道电流与间隙大小呈指数关系,获得原子级样品表面形貌特征图像。
- 利用扫描隧道显微技术,不仅可以获取样品表面形貌图像,还可以得到隧道谱,利用这些谱线可以对样品表面显微图像作逐点分析,以获得表面原子的电子结构等信息。扫描电镜图像是样品表面原子几何结构和电子结构综合反映。
- 原子力显微镜(AFM):类似于扫描电镜,是利用针尖与样品间的相互作用力产生的形变,可以用于研究绝缘体的表面形貌观察,对分析样品的导电性无要求。
4.2.2. X射线衍射(XRD)——物相分析
- X射线衍射机理:
- X射线照射晶体,电子受迫振动产生相干散射,同一原子内各电子散射波相互干涉形成原子散射波。由于晶体内各原子呈周期排列,因为各原子散射波之间也存在固定的相位关系而产生干涉作用,在某些方向上发生相长干涉,即形成衍射波。
- 衍射实质是散射波发生干涉的结果。
- X射线衍射方向:
- X射线照射到晶体上产生的衍射花样与晶体结构间有一定的内在联系,通过衍射花样的分析,就能测定晶体结构。
- 衍射花样包括衍射方向和衍射强度。
- 衍射方向可以用劳埃方程、布拉格方程等来描述。
- 劳埃方程的假设:设想原子受X射线照射产生球面散射波并在一定方向上相互干涉,形成衍射光束。
- 布拉格方程:X射线只有在满足布拉格方程的θ角才能发生反射。
- 散射线互相加强的条件为:2d sin θ = nλ。其中:n为反射级数,d为晶面间距,θ为衍射角。
- 两个重要规则:
- λ一定,d相同的晶面,必然在θ相同时才能获得反射。即用特征X射线照射多晶体,各晶粒中\(d\)相同的晶面,其反射线将有确定的方向关系。
- λ一定,d减小,θ角必须增大。说明面间距小的晶面,必须有大的衍射角(或称为掠射角或布拉格角),否则它们的反射线就无法加强。
- 主要用途:
- 已知晶体的d值。通过测量θ,求特征X射线的λ,并通过判λ断产生特征X射线的元素。这主要应用于X射线荧光光谱仪和电子探针中。
- 已知入射X射线的波长,通过测量θ,求晶面间距。并通过晶面间距,测定晶体结构或进行物相分析。
- <晶面信息的作用:一般研究的晶面都是具有活性的晶面。>
- <XRD的每一个峰代表一个晶面而非物质,多个晶面共同确定一个物质。>
- <XRD谱图出峰需要物质处于晶形,如果物质使无序排列的非晶态则不会产生峰。>
- X射线衍射强度:衍射强度是解决晶体结构中原子的种类和位置与衍射线强度之间的定量关系问题,主要取决于晶体的面间距,或者晶胞的大小。
- 分析思路:
- 一个电子对X射线的衍射强度。
- 一个原子对X射线的衍射强度。
- 一个晶胞(多个原子)对X射线的衍射强度。
- 多晶体样品对X射线的的衍射强度。
- 多晶体是由许多取向无规则的晶粒构成。每个晶粒并非理想的单晶体,而是具有亚晶结构。因此具有亚晶结构的实际晶体的衍射除了在布拉格角位置出峰外,还在偏离布拉格角的范围内有一定的衍射强度。这与晶体尺寸不够大,入射光非严格单色、非严格平行等因素有关。
- 半峰宽:在强度的一半高度对应一个强度峰的半峰宽B,它与晶粒大小的关系是\(B = \cfrac {\lambda}{t \cos \theta}\),其中t = m·d,m为晶面数,d为晶面间距。此为著名的谢乐公式,晶粒大小在亚微米至纳米尺寸范围时,可以通过衍射宽度测定晶粒尺寸。
- 分析思路:
- 方法和应用:
- 衍射实验方法分为劳埃法、转晶法和粉末法,获取多晶物质衍射图样多用粉末法。
- 粉末法可分为两大类:照相法和衍射法。
- 纳米材料晶相表征常用粉末衍射法。
- 衍射花样:物质对X射线的衍射产生了衍射花样或衍射谱,对于给定的晶体试样,其衍射花样与入射线的相对取向及晶体结构有关,有特定的衍射花样。
- 粉末衍射法:
- 粉末法是通过单色X射线照射多晶体样品(即样品是由细小的多晶质物质组成,样品中有无数个小晶粒,且各个晶粒的方向是随机的,无规则的)。入射X射线波长固定。通过无数取向不同的晶粒来获得满足布拉格方程的θ角。
- 粉末法是X射线衍射分析中最常用的方法。
- 粉末法主要由照相法和衍射仪法,早期粉末法主要为照相法(用底片记录X射线),现在衍射仪法越来越重要,大多数场合取代了照相法。
- 衍射仪测量具有方便、快速、准确等优点。近年由于衍射仪与电子计算机的结合,使从操作、测量到数据处理已大体上实现了自动化。
- 制样方法:压片法。
- X射线物相分析:物相分析是指确定材料由哪些相组成(物相定性分析)和确定各组成相的含量(物相定量分析)。
- 物相定性分析原理:
- 晶体物质都有其特定的结构参数,包括点阵类型、单胞大小、单胞中原子的数目及其位置等等,而这些参数在X射线衍射花样中均有所反应。没有两种衍射花样完全相同的物质。某种物质的多晶体衍射线条的数目、位置以及强度都可以作为该物质的特征和鉴别标志。
- 如果将几种物质混合后拍照,则将得到各单独相衍射线条的简单叠加。它们互不干扰,相互独立,逐一比较就可以在重叠的衍射花样中剥离出各自的衍射花样,分析标定后即可鉴别出各自物相。
- 物相定性分析标准卡片的建立及索引:
- 1938年由Hanawalt提出,公布了上千种物质的X射线衍射花样,并将其分类,给出每种物质三条最强线的面间距索引(称为Hanawalt索引)。
- 1941年美国材料实验协会(ASTM)提出推广,将每种物质的面间距d和相对强度及其他一些数据以卡片形式出版(称ASTM卡)。以后,ASTM卡片逐年增添。
- 1969年起,由ASTM和粉末衍射标准联合委员会(JCPDS),负责卡片的搜集、校订和编辑工作,之后的卡片称为粉末衍射卡,简称PDF卡,或称JCPDS卡。
- 1992年后,卡片统一由国际衍射资料中心(ICDD)出版。
- 至1997年,已有卡片47组,包括有机、无机相约67000张。
- 物相定性分析的步骤:
- 获得衍射花样(衍射图)。
- 从衍射花样上测量计算出各衍射线对应的面间距及相对强度。根据2θ值和布拉格公式计算d值。目前衍射仪可电脑自动采集数据并处理得到衍射峰的d和相对强度I值。
- 当已知待测化学组分,利用字母索引找出物质的三强线符合卡片,核对全部衍射线,一旦符合即可定性(口诀:三条最强线定物质)。
- 小结:
- 物相分析工作是将衍射谱数据收集成数据库,定性分析就是将实验数据与数据库的谱图进行比对。
- 定性分析原理:至今还没发现有两个物相的衍射谱数据完全相同,因此可以根据衍射谱数据区分物相。
- 定性分析方法:将所有物相的数据谱图进行比对。
- 定性分析工作主要是将获得的衍射谱数据与PDF卡片对照。其中难点是:如何在索引书中找到可能的物相范围;如何在混合物中逐一区分各个物相。
- 衍射数据中主要是晶面间距,衍射强度只辅助参考。
- 物相定性分析原理:
- 定量分析原理是:各个物相的含量与其衍射峰强度成正比关系,各种方法只是确定具体比例关系。
4.2.3. X射线光电子能谱(XPS)——元素组成分析
- X射线光电子能谱仪(XPS):是一种表面分析技术,主要用来表征材料表面元素及其化学状态。
- 基本原理:一定能量的X光照射到样品表面,和待测物质发生作用,将样品表面原子中不同能级的电子激发成自由电子,然后收集这些带有样品表面信息并具有特征能量的电子,通过研究他们的能量分布来确定样品表面的组成和化学状态。
- \(h\nu = E_{\mathrm k} + E_{\mathrm b} + E_{\mathrm r}\)。其中:\(h\nu\)为入射X光子的能量,\(E_{\mathrm k}\)为光电子的能量,\(E_{\mathrm b}\)为电子的结合能,\(E_{\mathrm r}\)为原子的反冲能量。
- 光电效应:XPS分析的基本原理。
- 在高于某特定频率的电磁波照射下,物质内部的电子会被光子激发出来,即光生电。
- 自由原子的光电效应能量关系:\(h\nu = E_{\mathrm k} + E_{\mathrm b}\)。对孤立原子或分子,\(E_{\mathrm b}\)(结合能)就是把电子从所在轨道移到真空所需的能量,是以真空能级为能量零点的。
- 根据\(E_{\mathrm b} = h\nu - E_{\mathrm k} - \varphi_{\mathrm {sp}}\)得到激发电子的结合能。
- 结合能:在某一元素的原子结构中某一轨道电子和原子核结合的能量。
- 与元素种类以及所处的原子轨道有关,能量是量子化的。结合能反映了原子结构中轨道电子的信息。
- 对于气态分子,结合能就等于某个轨道的电离能,而对于固态中的元素,结合能还需要进行仪器功函的修正。
- 化学位移:由于化合物结构的变化和元素氧化状态的变化引起谱峰有规律的位移。
- 原因:内层电子一方面受到原子核强烈的库仑作用而具有一定的结合能,另一方面又受到外层电子的屏蔽作用。因而元素的价态改变或周围元素的电负性改变,则内层电子的结合能改变。
- 规律:当元素的价态增加,电子受原子核的库仑作用增加,结合能增加;当外层电子密度减少时,屏蔽作用将减弱,内层电子的结合能增加;反之则结合能将减少。
- 谱图识别:全扫谱图——表面元素定性分析。是一种常规分析方法,一般利用XPS谱仪的宽谱扫描程序。
- 首先考虑消除荷电位移。
- 对于绝缘样品,必须进行校准。
- 一般来说,只要该元素存在,其所有的强峰都应存在。
- 激发出来的光电子依据激发轨道的名称进行标记。
- 从C原子的1s轨道激发出来的光电子用C 1s标记;同时以C-C的标准Eb = 284.80 eV对谱线进行校准。
- 同时激发出多个原子轨道的光电子。
- 大部分元素都可以激发出多组光电子峰。
- 谱图识别:高分辨率谱图——元素氧化态识别。
- 在XPS的应用中,氧化态的识别是最主要的用途之一。识别化合态的主要方法就是测量X射线光电子谱的峰位位移。
- 对于半导体、绝缘体,在测量化学位移前应首先确定定荷电效应对峰位位移的影响。
- 化合态识别-光电子峰:
- 由于元素所处的化学环境不同,它们的内层电子的轨道结合能也不同,即存在所谓的化学位移。
- 其次,化学环境的变化将使一些元素的光电子谱双峰间的距离发生变化,这也是判定化学状态的重要依据之一。
- 元素化学状态的变化有时还将引起谱峰半峰高宽的变化。
4.2.4. 红外吸收光谱(IR)——官能团分析
- 红外光谱基本原理:
- <红外光横轴一般为波数(cm-1),范围一般为4000 ~ 400。纵轴为透射率,峰为“倒峰”。>
- 红外光谱波长范围约为0.75 ~ 1000 μm,一般换算为波数。根据仪器技术和应用不同,习惯上分为三个区:
- 近红外光区:0.75 ~ 2.5 μm,13158 ~ 4000 cm-1。分子化学键振动的倍频和组合频。
- 中红外光区:2.5 ~ 25 μm,4000 ~ 400 cm-1。化学键振动的基频。
- 远红外光区:25 ~ 1000 μm,400 ~ 10 cm-1。骨架振动、转动。
- 傅里叶变换红外光谱仪(FTIR):基于对干涉后的红外光进行傅里叶变换的原理而开发的红外光谱仪。
- <空气中的水和二氧化碳会对仪器产生较大影响,需要长期通氮气维持干燥环境。仪器较脆弱。>
- 制样:KBr压片法。可使用的基质包括:KBr、KCl、NaCl、KI、CsI、PE powder。
- 红外吸收光谱与分子结构的关系:
- 特征吸收峰:代表基团存在并具有较强强度的吸收峰.
- 特征频率:所在位置的频率;分子或基团振动的相应频率。
- 理论计算 → 标准谱图数据 → 经验方法(根据文献等获得分子或基团的振动频率) → 与实验结果对照(确定某些分子或基团的存在)。
- X-H伸缩振动区:4000 ~ 2500 cm-1。
- O-H:3650 ~ 3200 cm-1。醇、酚、酸等。3650 ~ 3580 cm-1,低浓度(峰形尖锐),3400 ~ 3200 cm-1,高强度(强宽峰)。
- <红外光谱主要用于观察有机官能团,拉曼光谱可用于观察无机官能团。>
4.2.5. 紫外可见漫反射(UV-vis DRS)——能间带分析
- 基本原理:当光照射到固体表面时,发生反射和散射。
- 漫反射:当光束入射至粗糙的表面时,一部分光在表层各颗粒上产生镜面反射;另一部分光则折射入表层颗粒的内部,经部分吸收后射至内部颗粒界面,再发生反射、折射吸收。如此多次重复,最后由颗粒表层朝各个方向反射出来,这种辐射称为漫反射光。
- 紫外分光光度计与紫外漫反射的区别:前者采用透射方式 ,所测样品为溶液;后者采用漫反射的方式(积分球),所测样品为固体、粉末、乳浊液和悬浊液。
- 分子吸收光谱的波长分布是由产生谱带的跃迁能级间的能量差所决定的,反映了分子内部能级分布状况,由于不同物质分子能级的能量各异,因此不同物质将选择性地吸收不同波长或能量的外来辐射,这是UV-Vis定性分析的基础。
- 分子吸收谱带强度与该物质分子吸收的光子数成正比,这是UV-Vis定量分析的基础。
- UV-Vis吸收光谱解析:
- 若在200 ~ 750 nm波长范围无吸收峰,则可能是直链烷烃、环烷烃、饱和脂肪族化合物或仅含一个双键的烯烃等。
- 若在270 ~ 350 nm波长范围有低强度吸收峰,\(n \rightarrow \pi\)跃迁,则可能含一个简单非共轭且含有n电子的生色团,如羰基。
- 若在250 ~ 300 nm波长范围有中等强度的吸收峰,则可能含苯环。
- <UV254:254 nm是苯环的特征吸光波长。>
- 若在210 ~ 250 nm波长范围有强吸收峰,则可能含有2个共轭双键。
- 若在260 ~ 300 nm波长范围有强吸收峰,则说明该有机物含有3个或3个以上共轭双键。
- 若该有机物的吸收峰延伸至可见光区,则该有机物可能是长链共轭或稠环化合物。
4.2.6.比表面(BET)和孔隙度(BJH)分析
- 比表面积:单位质量物质的总表面积(m2/g),是超细粉体材料特别是纳米材料最重要的物性之一。
- 孔:固体表面由于多种原因总是凹凸不平的,凹坑深度大于凹坑直径就成为孔。微孔 < 2 nm,中孔2 ~ 50 nm,大孔50 ~ 7500 nm,巨孔 > 7500 nm(大气压下水银可以进入)。
- 孔容积或孔隙率:单位质量的孔容积, m3/g。
- 基本原理:在等温条件下,通过测定不同压力下材料对气体(最常用的气体为N2)的吸附量, 获得等温吸附线,应用适当的数学模型推算材料的比表面积,多孔材料的孔容积及孔径分布,多组分或载体催化剂的活性组分分散度。
- 等温吸附分类:由国际理论与应用化学联合会(IUPAC)提出的物理吸附等温线分类:I ~ VI六种类型。
- BET吸附等温方程:(\(S_{\mathrm {BET}} = V_{\mathrm m}L\sigma_{\mathrm m}\))
- 此公式目前测比表面应用最多,以77 K,氮气吸附为准,此时\(\sigma_{\mathrm m}\)= 16.2 Å2。
- BET二常数公式适合的\(p / p_0\)范围:0.05 ~ 0.25。
- 用BET法测定固体比表面,最常用的吸附质是氮气,吸附温度在其液化点77.2 K附近。
- 低温可以避免化学吸附的发生。将相对压力控制在0.05 ~ 0.25之间,是因为当相对压力低于0.05时,不易建立多层吸附平衡;高于0.25时,容易发生毛细管凝聚作用。
4.2.7. 粒径与表面电荷分析
- Zetasizer Nano系列粒度分析仪:能够提供液体介质中粒子或大分子的三种特性粒径、Zeta电位和分子量。
- DLS仪器中测量的粒径,是和被测量粒子以相同速度扩散的球体直径。
- Zetasizer仪器系统使用动态光散射(DLS)技术测量样品中粒子的布朗运动,然后使用已建立的理论拟合实验原始数据从而得到粒子的粒径和分布。
- Zeta电位和电泳:
- 大多数液体含有离子,它们可能是负性或正性电荷原子,分别称为阴离子和阳离子。当带电粒子悬浮于液体中时,相反电荷的离子会被吸引到悬浮粒子表面。即带负电样品从液体中吸引阳离子;相反,带正电样品从液体中吸引阴离子。
- 接近粒子表面的离子将会被牢固地吸附,而较远的则松散结合,形成所谓的扩散层。在扩散层内,有一个概念性边界;当粒子在液体中运动时,在此边界内的离子将与粒子一起运动;但此边界外的离子将停留在原处——这个边界称为滑动平面。
- 在粒子表面和分散溶液本体之间存在电位,此电位随粒子表面的距离而变化——在滑动平面上的电位叫做Zeta电位。
- Zeta电位测试原理:
- 应用电泳法和激光多普勒测速法相结合的测量技术,可测量Zeta电位。这种方法测量粒子所施加电场的液体中的运动的速度。
- 一旦我们知道粒子的电泳速度和所应用的电场强度,通过使用另外两个已知的样品参数——粘度和介电常数,我们可以计算出Zeta电位。
- Zeta电位和电泳结果解析:pHpzc——零电势点。
4.2.8. 其他重要分析手段
- 激光拉曼光谱法:属于分子振动光谱,是基于拉曼散射效应,对与入射光频率不同的散射光谱进行分析,以得到分子振动、转动方面信息,并应用于分子结构研究的一种分析方法。特点:
- 优点:红外非活性的振动信息可以由拉曼光谱获得,是红外光谱的补充技术。
- 缺点:可能破坏样品、对矿物拉曼效应很弱。
- 热分析技术:在程序控制温度条件下,测量物质的物理性质随温度变化的函数关系的技术。
- 理论基础:物质在加热或冷却的过程中,随着其物理状态或化学状态的变化(如升华、凝固、脱水、氧化、结晶、相变、化学反应等),通常伴有相应的热力学性质(如热焓、比热、导电系数等)或其他性质(如质量、力学性质、电阻等)的变化,因而通过对这些性质(参数)的测定可以分析物质的物理变化或化学变化过程。
- 常用技术:差热分析DTA、差式扫描量热法DSC、热重分析TGA。
第5讲 环境纳米修复技术:吸附
5.1. 吸附的基本原理
- 吸附:当两相组成一个体系时,其组成在两相界面与相内部是不同的,处在两相界面处的成分产生了积蓄(浓缩),这种现象称为吸附。所以吸附的本质为物质的相分配。
- 吸附质:被吸着和浓缩的物质。环境修复吸附体系中:污染物(金属和有机污染物)。
- 吸附剂:具有选择性吸着溶质的多孔表面固体。环境修复吸附体系中:材料(纳米材料)、土壤。
- 界面现象:
- 界面:指两相接触的约几个分子厚度的过渡区。若其中一相为气体,这种界面通常称为表面。
- 严格意义上讲,表面应是液体和固体与其饱和蒸气之间的界面,但习惯上把液体或固体与空气的界面称为液体或固体的表面。
- 在多相体系中,界面的问题非常重要。例如吸附、催化、润湿、乳化、破乳、起泡、分散、消泡、絮凝、聚沉等现象,都与界面密切相关,都是界面现象。
- 界面特征:两相间的界面并非几何平面,而是具有一定厚度的界面层——界面相。
- 界面特征:几个分子厚、结构和性质与两侧体相均不同。
- 吸附原理的微观表达:吸附质在表面层富集的现象。
- 吸附分类:物理吸附、化学吸附。
- 物理吸附:吸附剂与吸附质之间的作用力是范德华力,包括静电力诱导力和色散力。
- 特点:其吸热比较低、吸附速度快而且没有选择性。<外扩散,速度快。>
- 在吸附过程中物质不改变原来的性质,因此吸附能小,被吸附的物质很容易再脱离。如用活性炭吸附气体,只要升高温度,就可以使被吸附的气体逐出活性炭表面。
- 化学吸附:指吸附剂与吸附质之间发生化学作用,生成化学键引起的吸附,在吸附过程中不仅有引力,还运用化学键的力。
- 特点:其吸热比较高、吸附速度根据化学键的类型不同而有较大的差别,并且有一定的选择性。<内扩散,吸附剂与吸附质成键,速度慢。>
- 吸附能较大,要逐出被吸附的物质需要较高的温度,而且被吸附的物质即使被逐出,也已经产生了化学变化,不再是原来的物质。
- 实际过程:多种吸附的复合。水处理吸附——可有效地去除水中的臭味,使水中大部分比较大的有机物分子、芳香族化合物、卤代烃等能牢固地吸附在吸附剂表面上或孔隙中,并使腐殖质、合成有机物和低分子量有机物有明显的去除效果。
- 两者之间的本质区别是吸附质与吸附剂之间的作用力性质不同。物理吸附是由范德华力引起的,它的性质类似于蒸汽的凝聚和气体的液化;化学吸附涉及化学成键,吸附质分子和吸附剂之间有电子的交换、转移和共有。
- 物理吸附:吸附剂与吸附质之间的作用力是范德华力,包括静电力诱导力和色散力。
| 性质 | 物理吸附 | 化学吸附 |
|---|---|---|
| 吸附力 | 范德华力 | 化学键力 |
| 吸附热 | 较小,与液化热相似 | 较大,与反应热相似 |
| 吸附速率 | 较快,不受温度影响,一般不需要活化能 | 较慢,随温度升高速率加快,需要活化能 |
| 吸附层 | 单分子层或多分子层 | 单分子层 |
| 吸附温度 | 沸点以下或低于临界温度 | 无限制 |
| 吸附稳定性 | 不稳定,常可完全脱附 | 比较稳定,脱附时常伴有化学反应 |
| 选择性 | 无选择性 | 有选择性 |
- 吸附的步骤:待分离的料液通入吸附剂 → 吸附质被吸附在吸附剂表面 → 料液流出 → 吸附质解吸、吸附剂再生。
- 几个吸附的重要概念:
- 吸附平衡:在一定条件下,经过足够长的时间,吸附质在两相中的浓度不再变化,称为吸附平衡,对应的浓度称为平衡浓度。吸附平衡关系决定了吸附过程的方向和极限,是吸附过程的基本依据。
- 去除率:吸附质在液相中的去除比例(液-固界面)。\(R = \cfrac {c_0 - c_e}{c_0} \times 100\%\)。
- 吸附量:吸指单位面积的表层中所含溶质的物质的量与同量容积在溶液本体中所含溶质物质的量的差值。吸附剂所能吸附的吸附质的量。\(q_t = \cfrac {(c_0 - c_t)V}{m}\)。
- 对于指定的吸附剂和吸附质,吸附量的大小由吸附温度和吸附平衡时气体压强(或溶质浓度)决定。吸附量是吸附研究中最重要的物理量,对于了解和比较吸附剂与吸附质的作用、吸附剂的优劣、吸附条件等有重要意义。
5.2. 吸附机理
- 吸附质在吸附剂的多孔表面上被吸附的过程分为下列四步:
- 吸附质从流体主体通过分子扩散与对流扩散穿过薄膜或边界层传递到吸附剂的外表面,称为外扩散。
- 吸附质通过孔扩散从吸附剂的外表面传递到微孔结构的内表面,称为内扩散。
- 吸附质沿孔表面的表面扩散。
- 吸附质被吸附在孔表面上。
- 扩散控制:多数情况下内扩散速率较外扩散慢,吸附过程为内扩散控制;但有时外扩散速率比内扩散速率慢得多,吸附速率由外扩散速率决定,称为外扩散控制。
5.3. 吸附动力学
- 动力学理念:
- 是研究各种因素对化学反应速率影响的规律。
- 研究化学反应过程经历的具体步骤即所谓反应机理。
- 是探索将热力学计算得到的可能性变为现实性。
- 将实验测定的化学反应系统宏观量间的关系通过经验公式关联起来。
- 动力学模型:以动力学为理论基础,结合具体的实际或者虚拟的课题而作的有形或者是无形的模型。
- 吸附动力学:吸附过程的动力学研究主要用来描述吸附剂吸附溶质的速率快慢,通过动力学模型对数据进行拟合,从而探讨吸吸附机理。
- 动力学和热力学:
- 热力学:判断反应能否发生。热力学讨论的是物质间热能的转移和热能与其他能量的转换问题。(吉布斯自由能变和熵变)
- 动力学:判断反应的速率与程度。低数状态下物体(质点)的运动状态,核心是牛顿三大定律和能量守恒原理。(反应动力学常数)
- 准一级动力学模型:
- 在准一级动力学反应中,吸附质从溶液中到达吸附剂表面是受扩散步骤控制,吸附剂表面有只有一种结合位点。
- 基于固体吸附量的拉格尔格伦(Lagergren)一级速率方程是最为常见的。应用于液相的吸附动力学方程。
- 模型公式:\(\cfrac {\mathrm dq}{\mathrm dt} = k_1(q_e - q)\),边界条件\(t = 0\),\(q = 0\)。
- 得到:\(\ln (q_e - q) = \ln q_e - k_1t\),
- 其中:\(q_e\)为平衡吸附量,\(q_t\)为时间为\(t\)时的吸附量,\(k_1\)为一级吸附速率常数。
- 以\(\ln(q_e - q_t)\)对\(t\)作图,如果能得到一条直线,说明其吸附机理符合准一级动力学模型。
- 局限性:尽管一级动力学模型已经广泛地用于各种吸附过程,但它却有局限性。一级线性图是由\(\ln(q_e - q_t)\)对时间作图,因此必须先得到\(q_e\)值,但在实际的吸附系统中,可能由于吸附太慢,达到平衡所需时间太长,因而不可准确测得其平衡吸附量\(q_e\)值。因此,它常常只适合于吸附初始阶段的动力学描述,而不能准确地描述吸附的全过程。
- 准二级动力学模型:
- 是基于假定吸附速率受化学吸附机理的控制这种吸附涉及到吸附质与吸附剂之间电子对公用或转移。<化学成键。>
- 吸附质从溶液中到达吸附剂表面化学吸附机理控制的,吸附剂表面有两种结合位点。<几乎所有的吸附过程都满足准二级动力学模型。>
- 公式:\(\cfrac {\mathrm dq}{\mathrm dt} = k_2(q_e - q)^2\),边界条件\(t = 0\),\(q = 0\)。
- 得到:\(\cfrac {t}{q_t} = \cfrac {1}{k_2q_e^2} + \cfrac {t}{q_e}\),
- 其中:\(q_e\)为平衡吸附量,\(q_t\)为时间为\(t\)时的吸附量,\(k_2\)为二级吸附速率常数。
- 动力学图形解析:横轴为时间,纵轴为吸附量。
- 拟合曲线:横轴为\(t\),纵轴为\(t / q_t\),斜率为\(1 / q_e\)。
5.4. 吸附等温线
- 基本概念:\(q_{\mathrm e} = \cfrac {V(c_0 - c_{\mathrm e})}{w}\)。
- 其中:\(q_e\)为饱和吸附量,\(c_0\)为溶液初始浓度,\(c_e\)为吸附平衡后的溶液浓度,\(V\)为平衡容器中的溶液体积,\(w\)为投放使用的吸附剂质量。
- 在温度一定的条件下,如\(V\)、\(c_0\)一定,改变吸附剂的投加量或者吸附质的初始浓度\(c_0\),则水中剩余吸附质浓度\(c_e\)及\(q_e\)也随之改变。吸附量与剩余浓度不是线性关系。
- 吸附等温线:吸附剂的表面是不均匀的,被吸附的分子和吸附剂表面分子之间,被吸附的各分子之间的作用力各不相等,吸附等温线的形状也不相同。
- IV类吸附等温线:<存在迟滞回环(吸附和解吸附曲线不完全重合),表明材料是介孔材料。>可以认为是由于产生毛细管凝结现象所致。
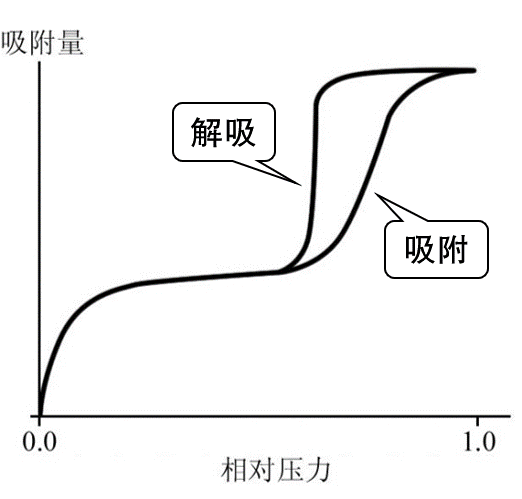
5.5. 吸附等温式
- 朗缪尔(Langmuir)方程:
- 基本假设:
- 吸附剂表面性质均一,各处吸附能相同。
- 吸附质在吸附剂表面为单分子层吸附,吸附剂表面饱和时,吸附量最大。
- 吸附是动态的,平衡时吸附速率 = 脱附速率。
- 吸附过程类似气体凝结过程,脱附类似液体的蒸发过程。
- 附质分子间无作用力,无吸附质转移运动。
- 表达式:\(q = \cfrac {k_1q_{\mathrm m}p}{1 + k_1p}\)。
- 其中:\(p\)是吸附质的平衡分压,\(q\)、\(q_{\mathrm m}\)分别是吸附量和单分子层吸附容量,\(k_1\)是朗缪尔吸附常数,与吸附剂和吸附质性质和温度有关,值越大表示吸附剂的吸附能力越强。
- 公式变换:\(\cfrac {1}{q} = \cfrac {1}{k_1 q_{\mathrm m}} \cdot \cfrac{1}{p} + \cfrac {1}{q_{\mathrm m}}\)。
- 尽管与朗缪尔方程完全吻合的物系相当少,但有大量的物系近似符合。该模型在低浓度范围就简化为亨利定律。朗缪尔模型被公认为定性或半定量研究变压吸附系统的基础。
- 基本假设:
- 弗兰德里希(Freundlich)方程:
- 表达式:\(q = kp^{1/n}\)。
- 其中:\(q\)为平衡吸附量,\(k\)为和吸附剂种类、特性、温度以及所用单位有关的常数,\(n\)为和温度有关的常数,\(p\)为吸附质气相中的平衡分压。
- 求解方式:取对数,\(\lg q = \lg k + \cfrac {1}{n}\lg p\)。
- \(\cfrac{1}{n}\)越小,说明吸附可在相当宽的浓度范围下进行。一般认为\(\cfrac{1}{n}\)= 0.1 ~ 0.5 时容易吸附。当\(n = 1\)时,转化为线性吸附方程:\(q = K_dc\);\(K_d\)称为分配系数。
- 弗兰德里希方程为经验公式:不但适用于气体吸附,也适用于液体吸附。就气体吸附而言,压力范围不能太宽,低压或高压区域不能得到满意的实验拟合结果。
- 液相吸附平衡:
- 液相吸附的特点:液相吸附机理比气相复杂,在吸附质发生吸附时,溶剂也有可能被吸附。
- 影响因素:影响液相吸附机理的因素除了温度、浓度和吸附剂的结构性能外,溶质和溶剂的性质对其吸附等温线的形状都有影响。在溶剂的吸附作用忽略不计时,可以认为是单组分吸附。
- 吸附等温线测定方法:假设溶剂不被吸附,或者液体混合物是溶质的稀溶液,测定溶液与吸附剂接触前后的浓度变化。
| 吸附类型 | 吸附等温方程 | 应用 |
|---|---|---|
| 单溶质、低浓度溶液的吸附 | Langmuir方程、Freundlich方程 |
|
| 多溶质、低浓度溶液的吸附 | 扩展的Langmuir方程 |
5.6. 吸附热力学
- 吸附热的定义:固体在等温、等压下吸附气体是一个自发过程,\(\Delta G < 0\),气体从三维运动变成吸附态的二维运动,熵减少,\(\Delta S < 0\),\(\Delta H = \Delta G + T \Delta S\),\(\Delta H < 0\)。 所以吸附是放热过程。
- 在吸附过程中的热效应称为吸附热。
- 物理吸附过程的热效应相当于气体凝聚热,很小;化学吸附过程的热效应相当于化学键能,比较大。
- 吸附热的取号:吸附是放热过程,但是习惯把吸附热都取成正值。
- 吸附热的意义:
- 吸附热的大小反映了吸附强弱的程度。
- 例如,催化反应中,一种好的催化剂必须要吸附反应物,使它活化,这样吸附就不能太弱,否则达不到活化的效果。但也不能太强,否则反应物不易解吸,占领了活性位就变成毒物,使催化剂很快失去活性。
- 好的催化剂吸附的强度应恰到好处,太强太弱都不好,并且吸附和解吸的速率都应该比较快。
5.7. 吸附影响因素
- 吸附剂:
- 比表面积:比表面积越大越好,对大分子可能不利。
- 孔结构:细孔的分布,大、中(过渡)、微孔。大孔——通道;中孔——吸附大分子;微孔——支配作用。
- 表面化学性质:表面氧化物——酸、碱两类。
- 表面呈酸性:水解后放出H+,吸附碱性物。
- 表面呈碱性:水解后放出OH-,吸附酸性物。
- 吸附质:
- 溶解度:越低越容易吸附。
- 极性:极性吸附剂易吸附极性吸附质,非极性吸附剂易吸附非极性吸附质。
- 分子量:活性炭易吸附分子直径较大的饱和化合物,分子筛易吸附分子直径较小的不饱和化合物。
- 溶质浓度:浓度增加吸附量增加,也有例外:等温线研究确定。
- 金属离子:在水中存在的形态。
- <重金属吸附首要控制元素:Pb、Hg、Cr、Cd、As;高毒性元素:Tl、U;次要控制元素:Be、Ag、Ni、Zn、Cu、Mn。>
- 操作条件:
- 接触时间:吸附动力学。
- 温度:吸附热力学——吸热/放热;吸附等温线——不同温度下的最大吸附量。
- pH:影响溶质存在状态;影响吸附剂表面性质。
- 共存物质:共存多种物质时吸附效果如何;环境吸附实验:水体中天然共存离子和天然有机质。(共存离子:竞争吸附;共存NOMs:促进/抑制。)
5.8. 解吸与再生
- 解吸再生:在保持吸附剂结构不发生或者稍微发生变化的情况下将吸附质由吸附剂的表面去除,以恢复其吸附性能的过程。是吸附的逆过程。
- 再生方法:加热再生法、化学氧化再生法、药剂再生法、生物再生法等。
- 药剂再生:用某种化学药剂将被吸附的吸附质解吸下来的过程为药剂解吸。其过程是在饱和吸附剂中加入适当的溶剂,改变吸附剂与吸附质之间的分子引力,改变介质的介电常数。打破原先的吸附平衡,吸附质离开吸附剂进入溶剂中,达到再生和回收的目的。
5.9. 环境吸附纳米材料
- 吸附法处理废水:
- 脱色,除臭味,脱除重金属、各种溶解性有机物和放射性元素等。
- 作为离子交换、膜分离等方法的预处理,以去除有机物、胶体物及余氯等。
- 作为二级处理后的深度处理手段,以保证回用水的质量。
- 环境吸附材料开发方向:
- 高比表面积吸附材料:
- 比表面积是吸附材料,特别是多孔吸附材料的重要指标。
- 活性炭吸附剂:常规活性炭比表面积在600 ~ 800 m2/g;超级活性炭比表面积在2500 ~ 4000 m2/g。通过改进活化方法和提高工艺参数(如KOH活化法),可以得到分布均匀的高比表面积的活性炭。
- 近来报道的金属有机物骨架材料(MOFs)的比表面可高达6240 m2/g,非常有利于吸附CO2。通过扩散法和容积热法合成,使其具有较高的比表面积、均一的孔道结构和较大的孔容积。
- 高密度官能团吸附材料。
- 有序介孔吸附材料。
- 高比表面积吸附材料:
- 领域研究趋势:吸附新兴污染物。
- 在环境吸附领域,除了常见的重金属和有机污染物之外,近年来,人们关注环境中的微量的新兴污染物,包括:持久性有机污染物(POPs)、药物和个人护肤品(PPCPs)、内分泌干扰物(EDCs)。
- 吸附法仍是去除这些污染物的有效方法,如何发挥吸附的优势,高效去除这些污染物也必将会是研究热点。
- 金属有机骨架化合物(MOFs)材料:
- MOFs是由无机金属中心(金属离子或金属簇)与桥连的有机配体通过自组装相互连接,形成的一类具有周期性网络结构的晶态多孔材料。
- 是一种有机-无机杂化材料,也称作配位聚合物,既不同于传统的无机多孔材料,也不同于一般的有机配合物。
- 常见的MOFs:ZTF-1、PCN-12、MIL-101(Cr)、HKUST-1、Bio-MOF-11、MOF-5、MOF-74 (Mg, Ni, Co)、MOF-200等。
- MOFs的命名规则:材料的成分、材料的结构、材料的功能、实验室或大学名字等。
- MOFs的组成:
- 无机金属中心、桥状有机配体、自组装、晶状多孔材料。
- 形成的四要素:金属的活性、有机配体的灵活性、官能团的选择性、特殊的空间结构。
- 主体结构是由次级结构单元与有机连接体之间的相互连接来构筑的,这类材料的孔径形状以及大小都可以通过选择不同的金属中心和有机配体来实现。兼具无机材料刚性和有机材料柔韧性的特征。
- MOFs的特点:迷人的拓扑结构、可剪裁性、结构多样性,易于进行设计组装和结构调控,可设计纳米多孔材料。
- MOFs的应用:气体储存、催化剂、分离、光电磁材料等。金属位能产生高度选择性和分子的储存与传送。
- <北京大学环境纳米实验室合成的MOFs命名:PLC-115 & PLC-117。>
第6讲 环境纳米修复技术:光催化
6.1. 光催化简介
- 学科发展背景:
- 太阳:一切能量的来源。
- 储存:化学相变储热、光化学储能。
- 转换:光化学合成、太阳能光解水,热解制氢。
- 利用:光电化学电池。
- 太阳能量谱:
- AM1:最常见的太阳光模式,约100 mW/cm2。<太阳光以0°直接穿过大气层到达海平面后的光谱。>
- <AM0:未考虑大气层。>
- <紫外光能量约占5% ~ 8%,可见光能量约占40% ~ 50%。>
- <紫外光波长一般在180 ~ 400 nm,可见光波长一般在400 ~ 750 nm。>
- 光催化技术是近年来迅速发展起来的可以利用太阳能进行环境净化和能源转化的技术,目前已经日臻成熟。
- 太阳:一切能量的来源。
- 学科基础与原理:
- 光催化学科是催化化学、光电化学、半导体物理、材料科学和环境科学等多学科交叉的新兴研究领域。
- 光催化定义:半导体材料在紫外及可见光照射下,将污染物短时间内完全降解或矿化成对环境无害的产物,或将光能转化为化学能,并促进有机物的合成与分解,这一过程称为光催化。
- <光催化一般是多相过程。>
- 多相光催化过程本质上是光诱导的氧化-还原反应过程。
- 半导体的能带结构:
- 半导体存在一系列的满带(充满电子),最上面的满带成为价带(valence band, VB);存在一系列的空带(没有电子),最下面的空带称为导带(conduction band, CB);价带和导带之间为禁带。
- 当用能量等于或大于禁带宽度(\(E_g\))的光照射时,半导体价带上的电子可被激发跃迁到导带,同时在价带上产生相应的空穴,这样就在半导体内部生成电子(\(\mathrm e^-\))-空穴(\(\mathrm h^+\))对。
- <半导体的能带宽度决定了该物质可以接受何种波长的光。一般选取能带宽度为1.5 ~ 3.5 eV的材料。如果能带宽度太高,难以产生光生电子;如果能带宽度太低,产生的光生电子极易返回价带,能量以热能散失。>
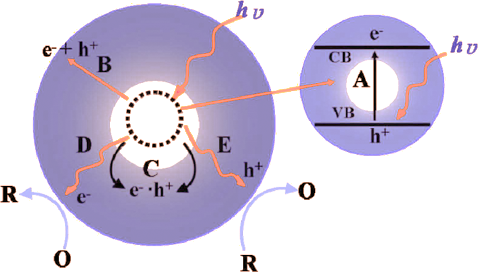
- 半导体光催化基本原理:
- 5个重要公式:
- \(\ce{TiO2 + \mathit{h\nu} -> \mathrm{e_{cb}}^- + \mathrm{h_{vb}}^+}\)。
- \(\ce{\mathrm{e_{cb}}^- + O2 -> O2^.-}\)。
- \(\ce{\mathrm{h_{vb}}^+ + H2O -> H+ + HO^.}\)。
- \(\ce{2O2^.- + 2H2O -> H2O2 + 2OH- + O2}\)。
- \(\ce{H2O2 + \mathrm{e_{cb}}^- -> OH- + HO^.}\)。
- 技术特征:
- 可以直接利用太阳光净化环境——绿色、节能。
- 室温下彻底降解污染物——特别是有毒难降解有机污染物。
- 有效杀灭细菌、病毒——包括典型致病菌、SARS、流感病毒。
- 安全、无二次污染——污染物被彻底氧化分解为CO2、H2O等无害产物。
- 广谱、长效——上百种污染物几乎都可被降解,催化剂长期使用。
- 关键科学问题:
- 技术难点:
- 量子效率低,约4%。
- 太阳光利用低,约5%。
- 工程化关键技术,如反应系统设计、催化剂负载、寿命等。
- 科学问题:
- 核心:高效光催化剂及构-效关系。
- 关键:提高光催化过程效率的途径。
- 本质:光催化过程的作用机理。
- 技术难点:
- 光催化剂与材料:光催化的核心是光催化剂,绝大多数为半导体,光催化的理论实则建立在半导体电子激发和转移上。近年来新型光催化剂研究取得重要进展。采用多种先进的方法和手段,设计并制备出一系列具有高效、高稳定性和可见光诱导性能的新型光催化剂,大大拓展了光催化剂的多元性和应用可选择性。
| 催化剂 | (eV) |
|---|---|
| Si | 1.1 |
| ZnO[a] | 3.2 |
| TiO2(金红石) | 3.0 |
| TiO2(锐钛矿) | 3.2 |
| WO3 | 2.7 |
| CdS[b] | 2.4 |
| ZnS | 3.7 |
| SnO2 | 3.8 |
| SiC | 3.0 |
| CdSe | 1.7 |
| Fe2O3[c] | 2.2 |
| α-Fe2O3 | 3.1 |
- 常见的光催化材料:。
- [a]:ZnO在水中不稳定,会在粒子表面生成Zn(OH)2。
- [b]:金属硫化物在水溶液中不稳定,会发生阳极光腐蚀,且有毒。
- [c]:铁的氧化物会发生阴极光腐蚀。
- 最常用的光催化剂:TiO2。纳米TiO2是当前最有应用潜力的光催化剂。
- 水中所含多种有机污染物可被完全降解成CO2,H2O等,无机污染物被氧化或还原为无害物。
- 不需要另外的电子受体。
- 具有廉价无毒,稳定及可重复利用等优点。
- 可以利用太阳能作为光源激活光催化剂。
- 结构简单,操作容易控制,氧化能力强,无二次污染。
6.2. 光催化反应机理
- 高级氧化法(AOPs):高级氧化技术又称做深度氧化技术,以产生具有强氧化能力的自由基(如·OH)为特点,在高温高压、电、声、光辐照、催化剂等反应条件下,使大分子难降解有机物氧化成低毒或无毒的小分子物质。根据产生自由基的方式和反应条件的不同,可将其分为光化学氧化、催化湿式氧化、声化学氧化、臭氧氧化、电化学氧化、Fenton氧化等。
| 氧化剂 | 反应式 | 氧化电位(V) |
|---|---|---|
| 羟基自由基 | 2.8 | |
| 臭氧 | 2.07 | |
| 过氧化氢 | 1.77 | |
| 高锰酸根 | 1.52 | |
| 二氧化氯 | 1.5 | |
| 氯气 | 1.3 | |
| 氧气 | 1.23 |
- 高级氧化技术的分类:均相氧化、非均相氧化。
- 一般而言,能够产生强氧化性自由基(如羟基自由基等)的工艺都可以归入高级氧化技术范畴。
- 基本过程:
- 当光能等于或超过半导体材料的带隙能量时,电子从价带(VB)激发到导带(CB)形成光生载流子(电子-空穴对)。
- 在缺乏合适的电子或空穴捕获剂时,吸收的光能因为载流子复合而以热的形式耗散。
- 价带空穴是强氧化剂,而导带电子是强还原剂。大多数有机光降解是直接或间接利用了空穴的强氧化能力。
- 光生空穴的氧化作用:
- 氧化反应既可以通过表面键合的羟基自由基(TiOH·+,表面-OH捕获空穴形成)而间接发生;也可以在微粒内部或表面捕获价带空穴之前,氧化反应与价带空穴直接发生。
- 在TiO2体系中,羟基自由基是其主要的氧化剂。
- 降解率和有机物污染物被吸附到表面的浓度的关联性实验结果也表明:羟基自由基和捕获的空穴能够在催化剂表面被直接利用。
- 鉴定自由基或空穴作用:自由基淬灭实验和电子自旋谐振(ESR)。
- <淬灭剂会和自由基反应,使得可与污染物反应的自由基含量减少,污染物去除率降低。>
- <ESR、EPR用于测定是否产生自由基,但不能证明自由基是否与污染物反应。淬灭实验测定自由基的效果。>
- 关于氧化反应是通过表面羟基自由基间接发生,还是价带空穴直接作用的问题,空穴和羟基自由基在光氧化HBA时有不同的区域选择性。
6.3. 光催化反应动力学
- 多相光催化反应:
- 多相光催化是指在有光参与的情况下,发生在催化剂及表面吸附物(如H2O、O2分子和被分解物等)不同相之间的一种光化学反应。
- 纳米TiO2是具有较大的比表面积和合适的禁带宽度的半导体材料,具有光催化氧化降解一些化合物的能力,具有优异的光催化活性,价格便宜,无毒无害等优点因此被广泛的应用。
- 光催化反应动力学方程:可用Langmuir-Hinshelwood (L-H)模型描述。原始方程:\(- \cfrac {\mathrm dc}{\mathrm dt} = r = k \cfrac {Kc}{1 + Kc}\),给定边界条件t = 0及c0,积分得到\(\ln \left ( \cfrac {c_0} {c} \right ) + K ( c_0 - c ) = kt\)。
- 当\(Kc \gg 1\)时简化为零级反应方程,\(- \cfrac {\mathrm dc}{\mathrm dt} = k\),积分得到\(c_0 - c = k_0t\)。
- 当\(Kc \ll 1\)时简化为一级反应方程,\(- \cfrac {\mathrm dc}{\mathrm dt} = kKc\),积分得到\(\ln (c_0 / c_t) = k_1t\)。
- 以上k,k0,k1 = kK。
- 电子供体和受体的吸附:
- 电子给体和受体吸附到半导体表面是光催化反应的决速步骤。
- 化学和静电力的叠加使基质开始接触半导体表面。
- 吸附作用包括:范德华力,诱导偶极-偶极相互作用,偶极-偶极相互作用,氢键,离子交换,表面有机物质分配,吸着物疏水性,半胶束形成等。
- 所有这些表面相互作用都产生特征Langmuir等温线。
6.4. 光催化反应影响因素和反应器
- 总述:一般催化剂本身特性,催化剂表面状态(电荷、吸附物质、缺陷、组成)、反应介质条件(pH值、溶剂)、反应物种类浓度、反应物吸附及产物解吸、氧浓度、光源(波长、强度、距离)等对光催化反应有决定性影响。
- 催化剂:
- 催化剂禁带宽度决定光的利用率: \(\lambda (\pu{nm}) = 1240/E_g (\pu{eV})\),1240是普朗克常数与光在真空中速度的乘积。
- 受能量大于半导体禁带能量的光子激发产生“电子-空穴”对,是半导体产生光催化反应的前提和基本条件。
- 半导体的禁带宽度直接影响着光催化反应的光利用率,拓宽光响应范围也成了研究热点。
- <禁带宽度\(E_g\)越小,\(\lambda\)越大,光的吸收边界提高,太阳能利用率提高。>
- <\(E_g\)可用UV-Vis DRS测定。>
- 半导体在其表面所发生的光致电子转移到吸附物上的能力,是由半导体导带和价带位置以及吸附物的氧化还原电位所控制。因此,不同催化剂的光催化活性不同。
- 如在光催化分解水的反应中,氧化型半导体的价带边低于O2/H2O的氧化还原电位,可以氧化水释放出氧气,还原性半导体的导带边高于H2/H2O的氧化还原电位,还原水释放氢气。氧化还原型的半导体的导带边高于氧化还原电位,价带低于氧化还原电位,可同时释放氧气和氢气。
- 即使同一种催化剂,由于其结构和表面形态不同,其光催化活性也不同。
- 催化剂禁带宽度决定光的利用率: \(\lambda (\pu{nm}) = 1240/E_g (\pu{eV})\),1240是普朗克常数与光在真空中速度的乘积。
- 操作条件:
- 溶液pH值影响(重要影响因素):其对半导体粒子在反应液中的颗粒物聚集度、表面电荷和有机物在半导体表面的吸附等有较大影响。
- 反应温度:在实际反应中,光催化反应对温度的变化不敏感,因为光催化反应的表观活化能很低,故反应速率对温度的依赖性不大。
- 反应物初始浓度:光催化氧化的反应速率可用L-H动力学方程描述。低浓度时,\(Kc \ll 1\),上式简化为\(r = kKc\),所以初始浓度越高,降解速率越大。但在高浓度范围内,反应速率与溶质浓度无关。
- 光催化反应设备:
- 间歇式反应器:多为透光效果好的玻璃管或水槽,结构简单,较适合于实验室研究和小批量的物料处理。间歇式反应器每次处理定量的样品,操作非常方便。
- 优点:光催化剂多以分散状均匀分散在体系中,与反应介质接触面积大,对紫外光的吸收效率高。
- 缺点:反应结束后催化剂微粒的回收非常困难,若要对产物分离纯化也很不便,不适宜于大批量物料的处理。
- 连续式反应器:催化剂多以固定相存在,在反应体系中分散度急剧降低,总反应面积减小且光吸收效果变差。另有某些反应受物质扩散过程的影响,比分散时的反应速率低一些。但催化剂固定后基本上杜绝了光催化剂的流失耗费,也无须再预先进行使催化剂均匀分散的繁琐步骤,适于大规模处理。
- 间歇式反应器:多为透光效果好的玻璃管或水槽,结构简单,较适合于实验室研究和小批量的物料处理。间歇式反应器每次处理定量的样品,操作非常方便。
6.5. 光催化材料研究进展:TiO2
- TiO2的结构和晶形:金红石(Rutile)、锐钛矿(Anatase)、板钛矿(Brookite)。
- 采用溶胶-凝胶法制备的纳米TiO2具有粒径小、分布窄、晶型为锐钛矿型、纯度高、热稳定性好、产率较高等优点,是一种非常具有发展潜力的合成方法,是有可能应用于工业生产的合成纳米材料的方法。
| 制备方法 | 优点 | 不足 |
|---|---|---|
| 液相沉淀法 | 粒径小,原料便宜易得 | 工艺流程长、废液多、产物损失较大,纯度低 |
| 溶胶-凝胶法 | 粒径小,分布窄,晶型为锐钛矿型,纯度高,热稳定性好 | 有机溶剂来控制水解速度,致使成本较高 |
| 醇盐水解法 | 常温进行,设备简单,能耗少,纯度高 | 大量有机溶剂来控制水解速度,致使成本较高 |
| 微乳液法 | 可有效控制TiO2颗粒的尺寸 | 易团聚 |
| 水热法 | 晶粒完整,粒径小,分布均匀,原料要求不高,成本相对较低 | 反应条件为高温、高压,材质要求高 |
- 锐钛矿相和金红石相TiO2的能带结构:
- 锐钛矿能带间隙3.2 eV,金红石能带间隙3.0 eV。
- 两者的价带位置相同,光生空穴具有相同的氧化能力;但锐钛矿相导带的电位更负,光生电子还原能力更强。
- 混晶效应:锐钛矿相与金红石相混晶氧化钛中,锐钛矿表面形成金红石薄层,这种包覆型复合结构能有效地提高电子-空穴的分离效率。
- <P25型混晶:80%锐钛矿 + 20%金红石。>
- TiO2光催化材料的特性:
- 原料来源丰富,廉价。但光致电子和空穴的分离转移速度慢,复合率高,导致光催化量子效率低。
- 光催化活性高(吸收紫外光性能强;禁带和导带之间能隙大;光生电子的还原性和空穴的氧化性强)。只能用紫外光活化,太阳光利用率低。
- 化学性质稳定(耐酸碱和化学腐蚀),无毒。但粉末状TiO2在使用的过程中存在分离回收困难等问题。
- 研究方向:TiO2改性,提高太阳能的转化率及光催化效率。TiO2是当前最具有应用潜力的光催化剂。
- TiO2光催化活性的影响因素:
- TiO2晶体结构的影响:在TiO2的三种晶型锐钛矿、金红石和板钛矿中,锐钛矿表现出较高的活性,原因如下:
- 锐钛矿较高的禁带宽度使其电子空穴对具有更正或更负的电位,因而具有较高的氧化能力。
- 锐钛矿表面吸附H2O、O2及OH-的能力较强,导致光催化活性较高。
- 在结晶过程中锐钛矿晶粒通常具有较小的尺寸及较大的比表面积,对光催反应有利。
- 催化剂颗粒直径的影响:催化剂粒子的粒径越小,单位质量的粒子数越多,比表面积越大,催化活性越高;但比表面积的增大,意味着复合中心的增多,如果当复合反应起主导作用的时候,粒径的减小会导致活性的降低,当粒径在1 ~ 10 nm级时会产生量子效应。
- 半导体禁带明显变宽,电子-空穴对的氧化还原能力增强。
- 半导体电荷迁移速率增加,电子与空穴的复合几率降低。
- 溶液pH值的影响:TiO2在水中的零电点(电荷为零的点)为pH = 6.25。
- 当溶液pH值较低时,TiO2表面质子化,带正电荷,有利于光生电子向表面迁移。
- 当溶液pH值较高时,由于OH-的存在,TiO2表面带负电荷,有利于光生空穴向表面迁移。
- 对于不同的物质光催化降解有不同的最佳pH值,而且对于降解的影响非常显著。实践证明,在pH = 3 ~ 9时,TiO2通常具有较好的催化活性。
- <pH < 2时部分Ti(IV)溶出;pH太大时不利于迁移。>
- TiO2晶体结构的影响:在TiO2的三种晶型锐钛矿、金红石和板钛矿中,锐钛矿表现出较高的活性,原因如下:
- 提高TiO2光催化活性的途径:
- 目前的TiO2光催化剂存在两个问题:量子效率低、太阳能利用率低。
- 改性和解决方法:贵金属沉积、复合半导体、离子掺杂修饰、表面光敏化、表面还原处理、表面鳌合及衍生作用、超强酸化。
- 贵金属沉积:
- 光生电子在Ag岛上富集,光生空穴向TiO2晶粒表面迁移,形成的微电池促进了光生电子和空穴的分离,提高了光催化效率。
- 金属离子可捕获导带中的电子,抑制电子和空穴的复合,但是掺杂浓度过高,金属离子可能成为电子空穴复合中心。金属离子的掺杂浓度对TiO2光催化效果的影响通常呈现抛物线关系。
- 半导体复合-构建异质结:
- 半导体复合的目的在于促进体系光生空穴和电子的分离,以抑制它们的复合,本质上可以看成是一种颗粒对另一种颗粒的修饰,其修饰方法包括简单的组合,掺杂,多层结构和异相组合,插层复合等。
- 当不同半导体的导带和价带分别相连时,若窄禁带半导体的导带具有比TiO2更低的电势时,则在可见光激发时,光生电子向能级更正的导带迁移,而光生空穴迁向能级更负的价带,从而实现光生电子和空穴的分离。
- 离子掺杂修饰:金属离子掺杂(Fe3+、Co2+、Cr3+)、非金属离子掺杂(碳、氮、硫、卤素)。
- 掺杂可以形成捕获中心,价态高于Ti4+的金属离子捕获电子,低于Ti4+的金属离子捕获空穴,抑制电子-空穴复合。
- 掺杂可以形成掺杂能级,使能量较小的光子能激发掺杂能级上捕获的电子和空穴,提高光子利用率。
- 掺杂可以导致载流子扩散长度增大,从而延长了电子和空穴寿命,抑制复合。
- 掺杂可以形成晶格缺陷,有利于形成更多的Ti3+氧化中心。
- 表面光敏化:
- 有机染料对TiO2的光敏化可以使光催化剂吸收的光波波长红移至可见光范围。
- 染料分子吸收太阳光,电子从基态跃迁至激发态,只要活性物质激发态电势低于半导体的导带电势,光生电子就有可能输送到半导体的导带上,而空穴则留在染料分子中,有效的抑制了电子与空穴的复合,这些光敏化物质在可见光下有较大的激发因子,使光催化反应延伸到可见光范围。常用的光敏化物质有劳氏紫、酞菁、玫瑰红、曙红等。
- 贵金属沉积:
- 纳米TiO2的环境应用:
- 无机污染物的光催化氧化还原:
- 光催化能够解决Cr(VI)、有机Hg、U(VI)等重金属离子的污染。
- 光催化还可分解转化其它无机污染物,如CN-、NO2-、H2S、SO2、NOx等。
- 有机化合物的光催化降解:烃、卤代烃、羧酸、表面活性剂、染料、含氮有机物、有机磷杀虫剂。
- 无机污染物的光催化氧化还原:
- 卫生保健方面的应用:灭杀细菌和病毒,可用于生活用水的杀菌消毒;负载TiO2光催化剂的玻璃,陶瓷等是医院、宾馆、家庭等各种卫生设施抗菌除臭的理想材料。
- 今后的研究方向:
- 半导体光催化材料的筛选、制备,半导体光催化活性产生的机制及所产生的活性物种。
- TiO2光催化剂的固定和尺寸量子化。
- 半导体光催化矿各种有机物的机理。
- 各种形式的半导体光催化反应器。
- 水中和气相各种污染物光催化降解动力学。
6.6. 光催化材料研究进展:g-C3N4
- 非金属聚合物半导体——新型可见光光催化剂(g-C3N4):
- 研究早期所报道的光催化剂都是含有金属组元的材料。
- 近些年来研究发现,不含金属的聚合物半导体石墨相氮化碳(g-C3N4)具有可见光光催化活性。
- 将其引入光催化领域,开展了初步研究,拓展了光催化研究特别是光催化材料研究的新方向。
- 化学合成:热诱导自聚合、热分析。
- 应用展望:初步研究结果表明,氮化碳聚合物半导体是一类有希望的新型可见光光催化材料,具有许多独特的性能,将丰富和拓展光催化领域的研究内容,在众多方面具有广阔的应用前景。
- 吸收可见光,高稳定性,不含金属成份,廉价易得,结构与性能易于调控,易于成膜和集成化,重量轻。
- <不足之处在于光催化效率不如TiO2。>
- 其他光催化材料:
- 金属氧化物:ZnO、WO、Fe2O3、SnO2、Bi2O3等金属氧化物都具有明显的光催化作用。
- II ~ IV族半导体:此类半导体的代表是ZnS、CdS、CdSe。单纯的这些半导体材料的光催化性能不高,主要是和其他的光催化剂如TiO2、SnO2、ZnO等进行复合,得到性能更好的复合半导体光催化剂。
- 钙钛矿型复合氧化物(ABO3):具有独特的电磁性质和氧化还原催化活性,其中稀土离子占据A位,过渡金属离子占据B位。它的光催化降解性是近年来研究的热门课题。
第7讲 环境纳米修复技术:催化
7.1. 催化的基本原理
- 催化作用与催化剂:
- 1835年,贝采利乌斯(Berzelius)首先提出“催化作用”概念。
- 元素符号来代表各种化学元素。
- 1803年发现铈;1817年发现了硒;1828年发现钍。另外还发现了硅、钫、钽、锗等等。
- 有机化学开山鼻祖。
- 1836年,他还在《物理学与化学年鉴》杂志上发表了一篇论文,首次提出化学反应中使用的“催化”与“催化剂”概念。
- 1902年,奥斯瓦尔德(W. Ostwald)定义催化作用:加速反应而不影响化学平衡的作用。
- 催化剂:是一种能够改变化学反应速度,而它本身又不参与最终产物的物质。
- 1835年,贝采利乌斯(Berzelius)首先提出“催化作用”概念。
- 国际理论和应用化学联合会(IUPAC)于1976年提出了催化作用的定义:催化作用是一种化学作用,是靠用量极少而本身不被消耗的一种叫做催化剂的外加物质来加速化学反应的现象。
- 1981年提出了催化剂的定义:催化剂是一种物质,它能加速反应的速率而不改变该反应的标准Gibbs自由焓变化。
- 涉及催化剂的反应统称为催化反应。
- 六个准则:
- 催化剂只加速热力学上可行的反应。
- 催化剂只能改变化学反应的速度,不能改变化学平衡的位置(即催化剂不影响Ka)。
- 促使热力学可自发发生的反应尽快发生,尽快达到化学平衡。
- 催化剂只是缩短到达平衡状态的时间,而不能改变其位置,即只改变动力学上的时间。
- 热力学判断反应能否进行,动力学判断反应进行快慢。
- 从热力学平衡常数来看,\(K = \exp \left( - \cfrac {\Delta G^\ominus} {RT} \right )\),平衡常数K由Gibbs自由能变\(\Delta G^\ominus\)和温度T决定,与催化与否无关。
- 从阿伦尼乌斯公式来看,\(k = A \exp \left( - \cfrac {E_{\mathrm a}} {RT} \right )\),反应速率常数k与活化能Ea有关,活化能的变化会影响速率常数,此为催化剂的功能。
- 实例:乙苯脱氢制苯乙烯,按平衡常数计算最大产率为72.3%,催化剂加速反应但不能使产率增加。
- 对达到/接近化学平衡的体系,催化剂对正逆反应的速度均按相同比例加速:\(K_{\mathrm a} = \cfrac {k_+} {k_-}\)。对正反应有效的催化剂对逆反应同样有效(热力学允许的反应)。
- 催化剂可以控制反应的方向,具有选择性。变换催化剂可以使反应高选择性的发生。
- 实例:和O2的反应,在PdCl2-CuCl2催化下生成CH3CHO,在Ag催化下生成,在Ni催化下生成CO2和H2O。
- 可利用催化剂的选择性抑制副反应,或提高产品质量。
- 催化剂可以改变催化反应历程。
- 实例:\(\ce{2Ce^4+ + Tl+ -> 2Ce^3+ + Tl^3+}\),加入Mn2+为催化剂后,历程改变,产物没有改变。双分子之间的碰撞机会大于三分子之间的碰撞机会(1018 ~ 1022倍),使反应速度增加。
- 催化剂降低反应活化能。
- 1902年油脂加氢生产硬化油,为近代有机工业的先河。(法国Sabatier1912年获诺贝尔化学奖)
- 1904开始德国化学家Haber研究合成氨催化剂(最经典的当属Fe催化,1918年获诺贝尔化学奖):最伟大、影响最深远的催化工艺。
- 催化对社会进步的贡献:
- \(\ce{N2 + 3H2 ->[Fe3O4-Al-2O3-K2O] 2NH3}\),合成氨熔铁催化剂。使化肥工业迅速发展,迎来了现代农业,1918年获诺贝尔化学奖。
- 乙烯、丙烯\(\ce{->[TiCl3-AlR3][Cp2TiPh2]}\)聚乙烯、聚丙烯,Ziegler-Natta催化剂。塑料产量增加了100倍,奠定了石化工业的基础,1963年获诺贝尔化学奖。
7.2. 催化类型与催化反应
- 催化类型:均相催化、异相催化、酶催化。
- 均相催化:
- 反应过程中催化剂与反应物是互溶的,以相同的相态存在。如:反应物和催化剂都是液态。
- 脱水、水合、聚合、酯的水解、醇醛缩合等反应采用酸性、碱性催化剂属于均相反应。
- 非均相催化:
- 涉及两相或两相以上,通常催化剂为固体,而反应物与产物为液体或气体。
- 非均相反应发生在流体与固体的界面及催化剂内部。
- 包括气-液、气-固、液-固反应、气-液-固反应。气-液相之间的反应通常由传质控制。
- 如果希望催化剂充分发挥作用,应当尽可能增加反应物与催化剂的接触。
- 多相反应固体催化剂(石化工业应用最多)。
- 催化功能来源于固体表面上存在的活性位点。
- 如膨润土、天然沸石和合成分子筛、氧化铝、硅铝胶、阳离子交换树脂,以及一些金属的硫酸盐(如NiSO4、CuSO4)、磷酸盐(如AlPO4、BPO4)、卤化物(如AlCl3、TiCl3、CuCl2),载于硅胶、硅藻土等上的无机酸(H2SO4、H3PO4、H3BO3)等。
- 用于催化裂化、催化重整、加氢裂化、异构化、甲苯歧化、醇类脱水、烯烃水合等反应过程。
- 酶催化:酶是生物催化剂。反应物是液态,催化剂为胶体。
- 应用:生物酶污水处理。
- 固体催化剂及其选择:成功的催化剂往往是活性组分和助催化剂及载体的完美结合。
- 活性组分:主催化剂、核心。
- 单独存在具有明显催化活性的成分,由一种或多种所组成。
- 常用的催化剂活性组分:金属(Ni、Cu、Zn、Fe等)、金属氧化物和硫化物(Fe2O3、Cr2O3、MoS2等)、盐类或酸性催化剂(ZnCl2等)。
- 要求:具有尽可能高的催化活性,选择性和抗毒性。
- 活性组分的选择,根据目前的知识水平只能有一个大致的方向,尚不能预先选择。
- 助催化剂:助剂、结构性和调变性。
- 在催化剂制备过程中所加入的物质,其本身很少或无催化活性,但由于这种物质的加入提高了催化剂的催化活性,选择性,或其强度及稳定性。
- 合成氨催化剂中:Al2O3,结构型助剂,改善还原态铁的结构。K2O,调变型助剂,有利于氮气的吸附和活化,也促进生成物氨的脱附。SiO2,稳定铁晶粒,增加催化剂的抗毒性和耐热性。MgO,提高耐热性和耐硫性。CaO,起助熔作用,使催化剂各组分易于熔融而形成均匀分布的高活性状态。
- 载体:兼做稳定剂和分散剂。
- 负载型催化剂的组成之一。催化活性组分担载在载体表面上,载体主要用于支持活性组分,使催化剂具有特定的物理性状,而载体本身一般并不具有催化活性。
- 载体可以是天然物质(如沸石、浮石、硅藻土、白土等),也可以是人工合成物质(如硅胶、氧化铝、活性炭等)。
- 常用“活性组分名称/载体名称”来表明负载型催化剂的组成,如加氢用的Ni/Al2O3催化剂。
- 载体的作用:增加有效表面、提供合适的孔结构;改善催化剂的机械性能,如抗磨性,抗冲压;提高催化剂的热稳定性;提供活性中心,节省活性组分用量,降低成本;与活性组分作用形成新化合物;增加催化剂的抗毒性能。
- 活性组分:主催化剂、核心。
- 催化剂的制备:
- 多种化学组成的匹配:各组分一起协调作用的功能催化剂。
- 一定物理结构的控制:粒度、比表面、孔体积。
- 不同制备方法,成分、用量相同,但催化剂的性能可能不同。
7.3. 纳米催化与催化性能
- 催化性能调控:空间尺度与尺寸效应。“界面”和“纳米”是催化的本征特性。
- 纳米特性与催化的关系:
- “纳米”是催化剂的本征特征。
- “纳米效应”能调变催化剂的电子特性。
- “纳米科学和技术”是理解催化原理的重要基础。
- “纳米”提供了一种不改变催化剂组成,而能有效、定量地调控多相担载催化剂表面结构和表面电子性质的有效途径,从而使在分子水平上对催化剂进行设计变得越来越现实。
- 纳米催化剂的分类:
- 纳米尺度催化剂:整体催化剂或活性位点处于纳米尺度。
- 纳米结构催化剂:具一定的纳米结构/纳米孔。
- 纳米粒子影响催化的因素:
- 纳米效应:大量的表面暴露原子数,高表面能,表面原子不需要按体相的规则排列,存在可能的量子尺寸效应。
- 尺寸——单原子催化:在加氢,CO氧化,甲烷转化,氧还原等反应中单原子均表现出优异的活性以及选择性。
- 晶面结构:固体催化剂的活性组分一般是暴露不同晶面的纳米粒子,而多相催化反应大多数在高达几百摄氏度的温度和高达几百个大气压的压力下进行,因此在多相催化反应过程中催化剂纳米粒子通常会发生表面再构,形成在多相催化反应条件对应的热力学稳定表面结构。如何控制催化剂纳米粒子表面再构过程和再构表面结构是制备高效纳米催化剂的挑战之一。
7.4. 纳米材料非均相催化环境修复应用
- 高级氧化技术:纳米材料加成高级氧化技术。
- SO4·-高级氧化技术:
- 传统高级氧化技术:产生羟基自由基(·OH),主要由H2O2、O3、超声、紫外光照射、空化空蚀等方法直接产生。标准氧化还原电位\(E_0\)= +1.8 ~ 2.8 V。
- 新型高级氧化技术:产生硫酸根自由基(SO4·-),主要由过一硫酸盐(PMS)、过二硫酸盐(PS)在热、紫外光照射、过渡金属离子(催化剂)等活化方式下产生。标准氧化还原电位\(E_0\)= +2.5 ~ 3.1 V。
- 同义概念:新型硫酸根自由基高级氧化技术、活化过硫酸盐的高级氧化技术、基于硫酸根自由基的高级氧化技术。
- SO4·-相比于·OH的优势:
- 在中性条件下SO4·-具备更高的标准还原电位,而在酸性条件下对目标污染物具有更强的选择性。
- SO4·-具有更长的半衰期(4 s),而·OH的半衰期为1 μs,延长了与目标污染物的持续接触时间,从而能够更高程度地矿化水中的有机污染物。
- SO4·-与有机物作用机理:
- 电子转移:对比研究·OH与SO4·-的氧化机制,认为SO4·-与芳香族化合物是通过电子转移的方式。
- 氢提取:应用激光闪光光解法测定反应速率,证明SO4·-与醇、醚、酯等的反应主要是通过氢提取。
- 加成:SO4·-主要是通过加成方式与含不饱和双键的烯烃类化合物反应。
- 硫酸根自由基前驱体:
- 单过硫酸氢钾(又名过氧化氮硫酸钾、过一硫酸氢钾,PMS),分子式KHSO5,存在2KHSO5·KHSO4·K2SO4(复盐、三聚盐)。
- 过硫酸盐(PS),分子式S2O82-,存在K2S2O8、Na2S2O8。
- PMS激发机理:单过硫酸氢盐产生[O]、羟基自由基、硫酸根自由基,主要有起始、传播、终止三个阶段。
- 起始阶段(活化阶段):单过硫酸氢盐可经光、热、催化等方式激发后,双氧键断裂,产生硫酸根自由基,方程式:\(\ce{SO5^2- ->[光/热/其他] SO4^.- + [O]}\)。
- (传播阶段:反应系统中产生一系列自由基链式反应:\(\ce{SO4^.- + H2O -> .OH + HSO4-}\),\(\ce{SO4^.- + OH- + .OH + SO4^2-}\)。)
- SO4·-和·OH可在水溶液中共存。
- 当pH超过7时SO4·-转变为强氧化性的·OH,因此过硫酸盐高级氧化技术适用pH范围广。但碱性环境下·OH氧化性略低于SO4·-,因此碱性环境氧化水处理效果较酸性或中性略低。
- Fe2+可与SO4·-竞争性反应,又可与·OH反应将其转化为OH-,可以消耗自由基,因此反应系统中铁盐浓度与自由基的产生速率有重要关系。
- (终止阶段:自由基淬灭,链式反应终止。)
- PMS激发活化方式:
- 过渡金属离子活化,如Fe2+、Cu2+、Mn2+、Ce2+、Co2+,在常温下可以活化过硫酸盐产生SO4·-。
- \(\ce{M^n+ + S2O8^2- -> M^{(n + 1)+} + SO4^.- + SO4^2-}\),\(\ce{M^n+ + HSO5- -> M^{(n + 1)+} + SO4^.- + OH-}\)。
- 相对于高温以及紫外光活化,常温下过渡金属离子活化过硫酸盐的技术更受到重视,并广泛用于各个方面。
- 钴离子均相催化:Co2+仍被认为是活化性能最好的过渡金属离子。
- 总结:
- 通过钴系催化剂活化过硫酸盐产生硫酸根自由基的高级氧化技术是一种新兴的降解有机污染物的方法。该方法无毒、高效、经济且环境友好。
- 钴系催化剂包括钴离子、钴氧化物、钴铁氧体和固定化钴催化剂,可以通过不同的方法合成。
- 非均相Co/PMS系统能够在中性的pH条件下实现高效降解有机物,有效减少钴离子溶出,且结构稳定、易于回收利用。
- 展望:关于钴系催化剂、非均相Co/PMS系统及其潜在应用有一些值得深入研究的方向:
- 基于不同的合成方式会有不同形态的纳米粒子,而不同形态的纳米粒子对活化效率的影响目前还缺少研究。
- 纳米粒子的合成方法还可以进一步研究。
- 均相Co/PMS系统广泛应用于地下水和土壤的原位化学修复,而非均相Co/PMS系统难以用于开放系统中。
- 净化水中遗留的过硫酸盐和产生的硫酸根对环境有消极影响,如何限制的PMS的剂量或原位再生PMS值得深入研究。
第8讲 环境纳米修复技术——纳滤和反渗透
8.1. 膜技术
| 分类 | 举例 | |
|---|---|---|
| 有机材料 | 纤维素类 | 二醋酸纤维素、三醋酸纤维素、醋酸丙酸纤维素、硝酸纤维素 |
| 聚酰胺类 | 尼龙-66、芳香聚酰胺、芳香聚酰胺酰肼等 | |
| 芳香杂环类 | 聚哌嗪酰胺、聚酰亚胺、聚苯并咪唑、聚苯并咪唑酮等 | |
| 聚砜类 | 聚砜、聚醚砜、磺化聚砜、磺化聚醚枫等 | |
| 聚烯烃类 | 聚乙烯、聚丙烯、聚丙烯腈、聚乙烯醇、聚丙烯酸等 | |
| 硅橡胶类 | 聚二甲基硅氧烷、聚三甲基硅烷丙炔、聚乙烯基三甲基硅烷 | |
| 含氟聚合物 | 聚全氟磺酸、聚偏氟乙烯、聚四氟乙烯等 | |
| 其他 | 聚碳酸酷、聚电解质 | |
| 无机材料 | 陶瓷 | 氧化铝、氧化硅、氧化锆等 |
| 玻璃 | 硼酸盐玻璃 | |
| 金属 | 铝、钯、银等 | |
| 膜过程 | 分离体系 | 推动力 | 分离机理 | 渗透物 | 截留物 | |
|---|---|---|---|---|---|---|
| 相1 | 相2 | |||||
| 微滤 | L | L | 压力差(0.01 ~ 0.2 MPa) | 筛分 | 水、溶剂、溶解物 | 悬浮物、颗粒、纤维和细菌(0.01 ~ 10 μm) |
| 超滤 | L | L | 压力差(0.1 ~ 0.5 MPa) | 筛分 | 水、溶剂、离子和小分子(分子量 < 1000) | 生化制品、胶体和大分子(分子量1000 ~ 300000) |
| 纳滤 | L | L | 压力差(0.5 ~ 2.5 MPa) | 筛分 + 溶解/扩散 | 水和溶剂(分子量 < 200) | 溶质、二价盐、糖和染料(分子量200 ~ 1000) |
| 反渗透 | L | L | 压力差(1.0 ~ 10.0 MPa) | 溶解/扩散 | 水和溶剂 | 全部悬浮物、溶质和盐 |
| 电渗析 | L | L | 电位差 | 离子交换 | 电解离子 | 非解离和大分子物质 |
| 渗析 | L | L | 浓度差 | 扩散 | 离子、低分子量有机质、酸和碱 | 分子量大于1000的溶解物和悬浮物 |
- 膜分离定义:在某种推动力的作用下,利用某种隔膜特定的透过性能,使溶质或溶剂分离的方法称为膜分离。分离溶质时一般叫渗析;分离溶剂时一般叫渗透。
- 根据推动力的不同,有下列几种:
- 浓度差:扩散渗析(分离离子、小分子) 。
- 电位差:电渗析(分离离子) 。
- 压力差:反渗透、纳滤、超滤、微滤。
- 膜分离的特点:
- 可在一般温度下操作,没有相变。
- 浓缩分离同时进行。
- 不需投加其他物质,不改变分离物质的性质。
- 适应性强,运行稳定。
- 膜分离尺寸概念:见。
| 项目 | RO | NF | UF | MF | |
|---|---|---|---|---|---|
| 孔径(nm) | 0.3 ~ 0.7 | 1 ~ 2 | 1 ~ 100 | 50 ~ 10000 | |
| 截留粒径(nm) | > 0.06 | > 1.0 | 2.0 ~ 100 | > 100 | |
| 是否带电 | 负电 | 负电 | 否 | 否 | |
| 运行压力(bar) | 8 ~ 69 | 3.5 ~ 20 | 1 ~ 7 | 0.5 ~ 0.7 | |
| 能截留的物质 | 盐分(%) | 98 ~ 99.6 | 20 ~ 90 | 0 | 0 |
| 病毒 | 完全 | 完全 | 部分 | 不能 | |
| 细菌 | 完全 | 完全 | 较完全 | 部分 | |
| 膜过程 | 推动力 | 传质机理 | 透过物 | 截留物 | 膜类型 |
|---|---|---|---|---|---|
| 微滤 MF |
压力差 | 颗粒大小和性状 | 水/溶剂、溶解物 | 悬浮物、颗粒 | 多孔膜 |
| 超滤 UF |
压力差 | 分子特性、大小和性状 | 水/溶剂、溶解物、小分子 | 胶体、大于MW-CO的物质 | 不对称膜 |
| 纳滤 NF |
压力差 | 离子大小、电荷 | 水、一价离子 | 有机物、多价离子 | 复合膜 |
| 反渗透 RO |
压力差 | 扩散传递 | 水 | 溶质、盐 | 不对称膜、复合膜 |
| 渗析 D |
浓度差 | 扩散传递 | 低分子物、离子 | 溶剂 | 不对称离子交换膜 |
| 电渗析 ED |
电位差 | 电解质离子的选择性传递 | 电解质离子 | 大分子物质、非电解质 | 离子交换膜 |
| 气体分离 GP |
压力差 | 气体和蒸汽的扩散传递 | 渗透性气体或蒸汽 | 难渗透的气体或蒸汽 | 均相符合膜、不对称膜 |
| 渗透蒸发 PV |
压力差 | 选择传递 | 易渗透的 | 难于渗透的 | 均相膜、复合膜、不对称膜 |
| 液膜分离 LM |
化学反应、浓差 | 反应促进和扩散传递 | 杂质 | 溶剂 | 乳状液膜、支撑液膜 |
| 膜蒸馏 MD |
蒸汽压力差 | 挥发性 | 挥发性大的组分 | 挥发性小的组分 | 疏水性膜 |
| 膜材料 | 优点 | 缺点 |
|---|---|---|
| 聚砜(PS)系列 |
|
|
| 聚偏氟乙烯(PVDF) |
|
疏水性;耐碱性低,不能在pH值高于12的环境中使用。 |
| 聚丙烯腈(PAN) | 强度高、弹性好、耐化学腐蚀、化学稳定性好,热稳定性好 | 耐压性一般,耐氧化性一般 |
| 醋酸纤维素(CA) | 可再生、可降解、对生物体无毒副作用、亲水性强、蛋白吸附率低、有较好的抗污染性、廉价 | 耐温性差、易被微生物吞噬分解、适用的pH值范围有限 |
| 聚丙烯(PP) | 电性能好、机械性能好,不易被微生物分解 | 过滤尺寸精度不易控制、耐光氧化性能较差、疏水性强、抗污染能力较差 |
| 壳聚糖膜(CS) | 天然高分子物质、良好的生物相容性、可控生物降解性 | 力学强度低、溶于弱酸 |
| 聚电解质复合物(PEC) | 良好的机械性能,对水、小分子电解质的透过性强 | 疏水性强 |
| 乙烯-乙烯醇共聚物(EVAL) | 亲水性强、机械强度好、膜通量高 | |
| 聚四氟乙烯(PTEE) | 耐溶剂型、化学稳定性、热稳定性 | |
| 聚苯基-1,2,4三嗪(PPT) | 耐高温、耐压密性强、耐水解性、制备条件容易 | |
| 无机膜 | 耐热、耐微生物、耐pH、耐有机溶剂、使用寿命长、孔径分布窄 | 贵、不耐强碱、脆性大、弹性小 |
| 有机-无机杂化膜 | 耦合了有机膜和无机膜的长处 |
- 膜组件型式:板框式、管式、中空纤维式等。
- 膜技术应用:苦咸水、海水淡化;饮用水处理新工艺(MF、UF、NF);纯水制备(UF、RO);废水深度处理(MF、RO);膜生物反应器等。
8.2. 纳滤
- 纳滤技术发展概况:纳滤(NF)是20世纪80年代后期发展起来的一种介于反渗透和超滤之间的新型膜分离技术,早期称为“低压反渗透”或“疏松反渗透”。
- 纳滤技术是为了适应工业软化水的需求及降低成本而发展起来的一种新型的压力驱动型膜过程。纳滤膜的截留相对分子质量在200 ~ 2000之间,膜孔径约为1 ~ 2 nm左右,适宜分离大小约为1 nm的溶解组分,故称为“纳滤”。
- 纳滤膜分离在常温下进行,无相变,无化学反应,不破坏生物活性,能有效地截留二价及高价离子和相对分子质量高于200的有机小分子,而使大部分一价无机盐透过,可分离同类氨基酸和蛋白质,实现高分子量和低分子量有机物的分离,且成本比传统工艺还要低。
- 纳滤膜:用于脱除多价离子、部分一价离子的盐类和分子量大于200的有机物的半透膜。
- 脱盐率:表示脱除给料液盐量的能力。公式:\(R = \left ( 1 - \cfrac {c_{\mathrm p}} {c_{\mathrm f}} \right ) \times 100\%\),其中:R为脱盐率,cp为透过液的含盐量,cf为给料液的含盐量。用于电渗析、反渗透、纳滤脱盐能力的表征。
- 道南(Donnan)效应:由于纳滤膜特殊的孔径范围和制备时的特殊处理(如复合化、荷电化),使其具有特殊的分离性能。纳滤膜的一个很大特征是筛分效应和电荷效应。电荷效应是指离子与膜所带电荷的静电相互作用。对不带电荷的分子的过滤主要是筛分效应,而对带有电荷的物质的过滤主要是靠荷电效应。大多数纳滤膜的表面带有负电荷,他们通过静电相互作用,阻碍多价离子的渗透,这是纳滤膜在较低压力下仍具有较高脱盐性能的重要原因。
- 纳滤膜的传质机理和模型:
- 纳滤与超滤、反渗透一样,均是以压力差为驱动力的膜过程,但其传质机理有所不同。一般认为,超滤膜由于孔径较大,传质过程主要为筛分效应;反渗透膜属于无孔膜,其传质过程为溶解-扩散过程(静电效应);纳滤膜存在纳米级微孔,且大部分荷负电,对无机盐的分离行为不仅受化学势控制,同时也受电势梯度的影响,即筛分效应和电荷效应的双重机理。
- 纳滤膜的传质模型主要有非平衡热力学模型、电荷模型、细孔模型和静电位阻模型四种。
- 纳滤过程确切的传递机理至今尚无定论。但多数认为:对于极性或荷电溶质,通过纳滤膜时的截留率由静电作用与位阻效益(筛分作用)共同决定;对于非极性溶质,截留率主要取决于位阻效应。
- 纳滤膜的制备方法:纳滤膜的表层较反渗透膜疏松的多,较超滤膜的表层又要致密的多,因此,纳滤膜制膜的关键是合理调节表层的疏松程度,以形成大量具有纳米级(10-9 m)的表层孔。
- 复合法:是目前用得最多也是最有效的制备纳滤膜的方法,也是生产商品化纳滤膜品种最多,产量最大的方法。该方法就是在微孔基膜上复合上一层具有纳米级孔径的超薄表层,它包括微孔基膜的制备、超薄表层的制备和复合。
- 微孔基膜的制备:只要有两种制备方法。一种是烧结法,可由陶土或金属氧化物(如Al2O3、Fe2O3)高温烧结而成,也可由高聚物粉末热熔而成;另一种是L-S相转化法,可由单一高聚物形成均相膜,如聚砜超滤膜,也可由两种或两种以上的高聚物经液相共混形成合金基膜。
- 荷电化法:是制备纳滤膜的重要方法,荷电膜大体可分为两类:一类是表层荷电膜,另一类是整体荷电膜。荷电化的方法主要有以下几种:
- 表层化学处理:该方法可先将带有反应基团的聚合物制成超滤膜,再用荷电性试剂处理表层以缩小孔径,如氯甲基化/季铵化聚砜膜。
- 荷电材料通过L-S相转化直接成膜:如磺化聚砜膜、氯化聚砜膜等。
- 含浸法:该方法是将基膜浸入含有荷电材料的溶液中,再借助于热、光、辐射、加入离子等方法使之交联成膜,这里膜基体和荷电材料基本上是物理结合。
- 成互聚合法:该 方法是将基膜浸入一种聚电解质和一种高分子的共溶液中,取出使之在一定条件下成膜,这类膜有聚阴离子膜和聚阳离子膜。聚阴离子膜一般为碱金属的磺酸盐,聚阳离子一般为聚苯乙烯三甲基氯胺。
- 复合法:是目前用得最多也是最有效的制备纳滤膜的方法,也是生产商品化纳滤膜品种最多,产量最大的方法。该方法就是在微孔基膜上复合上一层具有纳米级孔径的超薄表层,它包括微孔基膜的制备、超薄表层的制备和复合。
- 纳滤膜的污染:
- 无机污染:CaCO3垢主要是由化学沉降作用引起的,通过朗格里尔指数LSI的核算也表明要处理水的LSI值大于零,则有结垢的倾向。SiO2胶体颗粒主要是由胶体富集作用决定的。总的可认为膜的无机污染符合两步机理,即成核和长大。
- 有机污染:膜的特性,如表面电荷、憎水性、粗糙度,对膜的有机吸附污染及阻塞有重大影响。极性有机物在纳滤膜表面上的吸附可能以氢键作用、色散力吸附和憎水作用进行。对于非极性有机物:首先,憎水性有机物与水间的相互作用使这些扩散慢的有机物富集在膜表面上;其次,高分子有机物的浓差极化也有利于它们吸附在膜表面上;再次,水中离子(主要是Ca2+)与有机物官能团相互作用,会改变这些有机物分子的憎水性和扩散性。
- 微生物污染:一般膜进水的TDS(溶解于水中的总固体含量)是产水的10倍左右,同时由于边界层效应和生物黏垢的形成,进水在膜表面上为非均匀混合,使得进水中的有机物、无机物更容易浓缩在膜上,膜表面的这种特殊物理化学与营养环境将影响那些最终在膜表面的微生物的生长。
- 纳滤膜的清洗:
- 一般情况下,清洗时先用低pH值后用高pH值的洗液,这主要与膜上污染物的形成因素有关。系统运行过程中,胶体粒子和有机物污染最先在膜上沉积和吸附,形成膜表面的第一层垢;碳酸盐及金属氧化物垢是逐渐形成的,沉积于胶体垢之上,并缓慢渗入胶体中。因此,先用酸性溶液去除上部污垢,并可达到松动下层胶体的作用;然后再用碱性溶液清洗,可快速达到清洗效果。
- 纳滤膜的应用:纳滤膜主要应用于以下场合:单价盐不需要有较高的脱除率;分离不同价态的离子;分离高分子量与低分子量的有机物。
- 饮用水制备:纳滤膜最大的应用领域是引用水的软化和有机物的脱除。随着水污染的加剧,人们对饮用水水质越来越关心。传统的饮用水处理主要通过絮凝、沉淀、砂滤和加氯消毒来去除水中的悬浮物和细菌,而对各种溶解性化学物质的脱除作用很低。随着水资源贫乏的日益严峻、环境污染的加剧和各国饮用水标准的提高。可脱除各种有机物和有害化学物质的“饮用水深度处理技术”日益受到人们的重视。纳滤膜可以去除消毒过程产生的微毒副产物、痕量的除草剂、杀虫剂、重金属、天然有机物及硫酸盐和硝酸盐等。因此称为21实际饮用水净化的首选技术。
8.3. 反渗透
- 反渗透(RO):以压力差为推动力,从溶液中分离出溶剂的膜分离操作。因为它和自然渗透的方向相反,故称反渗透。根据各种物料的不同渗透压,就可以使用大于渗透压的反渗透压力,即反渗透法,达到分离、提取、纯化和浓缩的目的。
- 分离特性:高于溶液渗透压的压差为推动力,工作压力几十kg。
- 分离对象:溶质、小分子物质。
- 脱盐率作为重要的指标。
- 水回收率:\(m = \cfrac {Q_{\mathrm f}} {Q}\),其中:Q为进水流量,Qf为淡化水流量。对于RO一般70% ~ 80%。
- 反渗透的应用:主要用于水的纯化,如海水和苦咸水脱盐制饮用水,以及制备半导体工业、医药、化学工业中所需的超纯水。反渗透也用于浓缩过程,包括:食品工业中果汁、糖、咖啡的浓缩;电镀和印染工业中废水的浓缩;奶品工业中生产干酪前牛奶的浓缩。
- RO膜的用途:
- 超纯水:半导体、液晶产业用水。
- 饮用水:海水淡化、苦咸淡化、食品、饮料行业纯净水。
- 废水回用:循环冷却用水、工业及市政废水回用。
- 纯水:锅炉用水、各种工业过程工艺用水。
- 水的精制:软化、去除农药等有机物。
- 浓缩分离:各种有用物质的分离、回收、精制、浓缩等。
第9讲 环境纳米监测技术
9.1. 传感器的简介和基本原理
- 换能器和传感器:
- 换能器(Transducer):用于将某种能量形式转换为另一种能量形式信号的设备。包括:机械能、热能、电磁能、光能、化学能等。需要传感器和执行器。
- 传感器(Sensor):如温度计,用于检测、测定外界信号或刺激的设备。
- 执行器(Actuator):如加热器,用于输出信号或刺激的设备。
- 传感器系统:主要研究电子传感器,其将所需的参数转换为可测的电信号。
- 常用的电信号传感器:
- 主传感器:将真实世界的参数转换为电信号。
- 辅助传感器:将电信号转换为模拟或数字值。
- 典型的电信号系统:\(\ce{->[\text{信号输入}]}\)传感器\(\ce{->[\text{传感器数据}][\text{模拟/数字信号}]}\)控制器\(\ce{->[\text{网络展示}]}\)。
- 常用的电信号传感器:
- 电信号检测:化学信息获取。特点:
- 高度集成,同时检测不同物种的小型设备。
- 易于处理、显示、传输数据,为全自动设备所必需。
- 与微电子兼容,可利用现有的微技术。
- 各种类型的传感器:气体传感器、湿度传感器等。
- 纳米管、纳米线、纳米带传感器。
9.2. 纳米传感器的简介和基本原理
- 基于纳米材料的传感器:
- 随着工业社会的发展,环境污染问题日益严重,有效的环境监测技术设备可为环境污染治理提供有力的技术支持,也是实现环境安全、促进社会可持续发展的迫切要求之一。
- 纳米材料具有独特的微观结构,呈现出诸多常规材料不具有的优越性能,因此在环境监测方面有很大的应用空间。
- 纳米材料的优势:巨大比表面积、高催化活性、吸附能力强,促进更高的敏感性、更低的检测限、更快的响应速度。
- 传统环境监测技术使用大型的设备和复杂的样品制备,昂贵耗时;传感器易于制备,低成本,高灵敏度和选择性;纳米材料具有大的表面积,高表面反应性,高催化效率和强吸附能力,具有独特的化学,物理,光学,催化和电子特性;基于纳米材料的传感器体积小,响应时间快,灵敏度和选择性高。
- 纳米传感器:传感器间的缝隙间距达到了纳米级别,保证了很高的传感灵敏度。
- 背景:当今纳米技术的发展,不仅为传感器提供了良好的敏感材料,例如纳米粒子、纳米管、纳米线、纳米薄膜等,而且为传感器制作提供了许多新颖的构思和方法,例如纳米技术中的关键技术STM,研究对象向纳米尺度过渡的微机电系统(MEMS)技术等。
- 优点:与传统的传感器相比,纳米传感器尺寸减小,精度、灵敏度等性能大大改善,更重要的是利用纳米技术制作传感器,是站在原子尺度上,从而极大地丰富了传感器的理论,推动了传感器的制作水平,拓宽了传感器的应用领域。
- 用于环境监测:基于纳米材料设计的传感器已被证明是一种有前途和可靠的工具,用于快速检测和监测水质参数以及水中常见的污染物,包括重金属离子(如Hg2+,Pb2+,Cd2+,Cr(VI),Cu2+,Co2+,As3+),游离余氯,COD,生化需氧量(BOD),NO2-,SO32-,SO42-,CH3,农药,酚类污染物,微生物,生物毒素,持久性有机污染物,新兴化学污染物等。
- 纳米材料的检测优势:有趣的化学和物理特性——尺寸、电导率、机械强度、磁性、光学特性等。
- 在电化学传感中,可作为分子线以增强电子转移或作为催化剂以加速化学反应。
- 在光学检测中,可以作为设计新型检测系统的光学探针。
- 在分离科学中,可以作为固定相或吸附剂,因为它们具有大的表面积和对污染物分子的特定亲和力。
- 使用磁性纳米材料可以促进固相萃取(SPE)并节省样品制备的时间。
- 纳米材料架构:量子点(QDs)、碳纳米管(CNTs)、石墨烯家族(GFMs)、贵金属、金属氧化物NPs等。可用于设计基于不同原理和方法的纳米传感器,如荧光方法、电化学方法、光化学方法、比色法、表面增强拉曼光谱(SERS)、紫外-可见光谱等。
- 半导体量子点:QDs的独特光物理特性,如高荧光量子产率,窄发射带,高斯托克斯位移和光漂白稳定性,使其成为感应事物的理想光学标签。
- 荧光QDs传感器已经被广泛研究,已用于金属离子、小分子、农药和工业废水。
- CdTe量子点的表面配位起源荧光共振能量转移(FRET)和简单的配体置换启动机制,用于高灵敏度和选择性检测有机硫代磷酸酯农药,无需昂贵的抗体或酶。
- 碳基纳米材料:
- CNTs和GO具有优异的导电性,并且已经在构建用于重金属离子检测的FET传感器中得到应用 → 一种选择性,灵敏,快速的单壁碳纳米管(SWCNT)基场效应晶体管纳米传感器,用于Hg2+离子检测。
- CNTs和GO可促进电极和电活性物质之间的电子转移:多壁碳纳米管(MWNT)来制造基于乙酰胆碱酯酶(AChE)的电化学传感器检测农药上,表现出快速响应和高灵敏度的特点。
- 基于半导体纳米材料暴露于气体的电导率变化:利用石墨烯作为传感器对CO、NO2和NO的检测;单壁碳纳米管对NO2、SO2和NH3具有很强的敏感性。
- 金属纳米颗粒:
- 金属纳米颗粒,尤其是金纳米颗粒(AuNPs)和银纳米颗粒(AgNPs)由于其在化学和生物传感器,医学诊断和治疗以及生物成像中的潜在应用而受到广泛关注。
- 引入了Pb2+特异性DNAzyme作为靶识别元件和DNA功能化金纳米粒子作为信号元件,并设计了比色Pb2+生物传感器。
- 一系列基于AuNPs或AgNPs颜色的比色传感器,从红色到蓝色,可以原位使用,无需复杂分析仪器的实时定性或半定量检测。
- 硅基纳米材料:
- 具有优异的电子/机械/光学性能,良好的生物相容性,表面可裁剪性以及与传统硅技术的兼容性等特性。
- 金纳米粒子-修饰的硅纳米线(AuNPs@SiNWs)可以极大地改善基于乙酰胆碱酯酶(AChE)的电化学传感器的性能。
- 构建基于SiNWs的FET传感器用于环境监测,用于快速,无标记检测的硅纳米线-FET器件大规模阵列2,4,6-三硝基甲苯(TNT)。
- 总结:
- 纳米材料独特的化学和物理特性为开发各种检测技术提供了一个多功能的工具箱,具有高灵敏度,特异性,速度,简单性和成本效益,可用于环境监测,前景广阔。
- 从实用的观点来看,仍然迫切需要进一步提高灵敏度,并且可能更重要的是,操作便利性。大规模生产的可能性也是基于纳米材料的传感器的广泛应用的关键点。
- 应用分类:
- 纳米气敏传感器:
- 气敏传感器上和敏感气体接触的表面附着了一层纳米涂层作为敏感材料,用于改善传感器的灵敏度和性能。
- 用零维的金属氧化物半导体纳米颗粒、碳纳米管及二维纳米薄膜等都可以作为敏感材料构成气敏传感器。
- 纳米化学和生物传感器:
- 将纳米材料作为一种新型的生物传感介质,与特异性分子识别物质。如酶、抗原、抗体、DNA等相结合,转换成一定信号输出识别。
- 纳米材料量子尺寸效应和表面效应,可把传感器的效能提高到新水平,使其不仅体积小,而且反应速度快、精度高、可靠性好,还能实现多功能化和选择性检测。
- 疾病监测:用于疾病早期的诊断和监测。
- 其他类型的纳米传感器(流量、压力和温度等)。
- 纳米气敏传感器:
- 纳米材料安全性评估:
- 环境的影响,需要采用能适应不同条件的多种传感器,包括分别或同时监测纳米材料暴露在空气和水中的情况及其可能造成的危害的仪器。所以未来3 ~ 10年内开发出评估纳米材料暴露在水与空气中的影响的仪器。
- 目前整日与纳米材料打交道的人迫切需要廉价的、便携的、可广泛使用的空中样本收集器,以测量工作环境中的纳米材料暴露情况,包括其数量、比表面积和聚集等数据。这样的仪器需要在未来3年内商业化。
- 纳米产品制造过程中排出的废物,如防晒油等液体消费品中的纳米颗粒,不可避免地会在水中堆积。不追踪这些废物,就不能确定纳米颗粒存在的好坏。因此,需要在未来5年开发追踪纳米颗粒在水中散落聚集和转化情况的仪器。
- 需要在未来10年内开发相关智能传感器,以直接探测和显示出纳米颗粒对人体健康与环境的危害情况。
9.3. 气敏传感器
- 气敏传感器的发展历史:
- 气体传感器是指能够将气体浓度转化为电信号的装置;气敏性能是指气体传感器对目标气体响应电信号的强弱。
- 1964年,当时Wickens和Hatman根据气体在电极上的氧化还原反应制作出了历史上的第一个气体传感器。
- 1982年,英国科学家Persaud等人提出了可以利用气体传感器来模拟动物的嗅觉系统。
- 此后,气体传感器有了飞速的发展,并被应用到了其他领域,如环境检测、气体泄漏检测等。
- 气敏传感器的应用:化工、环境污染、火灾报警、煤矿等。
- 气体浓度的表示:
- 对环境大气(空气)中污染物浓度的表示方法有两种:
- 质量浓度表示法:每立方米空气中所含污染物的质量数,即mg/m3。
- 体积浓度表示法:一百万体积的空气中所含污染物的体积数,即ppm。
- 大部分气体检测仪器测得的气体浓度都是体积浓度(ppm)。而按中国规定,特别是环保部门,则要求气体浓度以质量浓度的单位(mg/m3)表示,中国的标准规范也都是采用质量浓度单位(如:mg/m3)表示。
- 对环境大气(空气)中污染物浓度的表示方法有两种:
- 气敏传感器:是用来检测气体类别、浓度和成分的传感器。 由于气体种类繁多,性质各不相同,不可能用一种传感器检测所有类别的气体,因此,能实现气-电转换的传感器种类很多,按构成气敏传感器材料可分为半导体和非半导体两大类。目前实际使用最多的是半导体气敏传感器。
- 实际应用:气敏传感器应用较广泛的是用于防灾报警,如液化石油气、天燃气、城市煤气、煤矿瓦斯以及有毒气体等方面的报警器。还对大气污染进行监测以及在医疗上用于对O2、CO2等气体的测量。生活中则可用于甲醛检测、烹调装置、酒精浓度探测等方面。
- 常见气敏传感器的分类:
- 接触燃烧式气体传感器:检测元件一般为铂金属丝(也可表面涂铂、钯等稀有金属催化层),使用时对铂丝通以电流,保持300 ~ 400 ℃的高温,此时若与可燃性气体接触, 可燃性气体就会在稀有金属催化层上燃烧,因此,铂丝的温度会上升,铂丝的电阻值也上升;通过测量铂丝的电阻值变化的大小,就知道可燃性气体的浓度。
- 电化学气敏传感器:一般利用液体(或固体、有机凝胶等)电解质,其输出形式可以是气体直接氧化或还原产生的电流,也可以是离子作用于离子电极产生的电动势。
- 半导体气敏传感器:半导体金属氧化物气敏传感器具有结构简单、成本低、能够实现在线检测、并与微电子制作技术相兼容等优点,能广泛应用于工业废气、汽车排放尾气和环境污染气体检测。半导体金属氧化物,如ZnO、SnO2、MoO3、WO3、In2O3等,是制作半导体气体传感器常用的纳米材料。
- 气敏传感器的主要特性:
- 稳定性和重复性:多次使用后仍然能够对目标气体进行检测。
- 灵敏度:对较大浓度范围内的气体都有很好的响应,尤其是对低浓度气体的响应。
- 选择性:对不同气体有不同的响应信号,并且对目标气体的响应要好于其他气体,以此来区分不同的待测气体。
- 响应和恢复时间:气体传感器对目标气体的响应要快,并且恢复时间要短。
第10讲 纳米材料环境行为与毒理
10.1. 介绍
- 总述:大量工程纳米材料(ENMs)通过各种方式进入环境,称为纳米污染物(NPs)。
- 纳米材料的来源:可分为自然来源(生物、地理、大气等)、偶然来源(化石能源、发电等)、工程来源(人类有意识地制造纳米材料)。
- 工程纳米材料(ENMs):人类设计,具有特定性质或组成,通过物理化学过程生成。
- 纳米材料的生命周期:纳米材料的环境行为与去向、纳米材料的健康影响、纳米材料污染物的管理、污水处理厂中的行为和影响、自然产生的纳米颗粒(NNPs)。
10.2. 纳米材料的环境行为与去向(水和土壤)
- 纳米材料进入水体的重要过程:团聚、沉降、溶出、转化、氧化、还原、吸附、降解、悬浮、固定等。
- 团聚:在胶体悬浮液中形成纳米材料簇。存在均相团聚和异相团聚。遵循DLVO理论。可以用碰撞率和附着效率计算团聚率。
- 团聚稳定性影响因素:纳米材料的性质(粒径、电荷、Zeta电位、图层、零电势点pHpzc、颗粒密度、磁化等)、环境特征(pH、离子强度、有机物浓度、悬浮颗粒物浓度等)、初始纳米颗粒浓度等。
- Zeta电位是决定纳米颗粒是否稳定的重要参数。
- 沉降:纳米材料可以通过重力沉降、吸附在天然有机物(NOM)或其他悬浮颗粒物上沉降。沉降速率比团聚速率低。
- 团聚颗粒的粒径是影响沉降速率的重要因素。
- 沉降可以用斯托克斯定律计算。沉降发生必须使沉降速率大于等于临界沉降速率。
- 陈阿竞速率有三个阶段:初始阶段缓慢,随后快速沉降,最后又变得缓慢。
- 溶出:设计可溶性离子的释放,是表面控制的过程。表面积越大溶出越多。一般在极低pH下溶出性变强。
- 溶出性取决于热力学。
- 溶出速率是原子和纳米颗粒表面结合强度的函数,同时也受颗粒表面和介质金属离子浓度梯度、环境特征等的影响。纳米材料粒径和表面化学性质也会影响溶出程度和速率。
10.3. 环境纳米材料的毒性和健康效应
- 纳米材料释放到环境的直接或间接源:纳米材料的制造和加工、炼油工艺、化学和材料制造工艺、化学清理活动、纳米材料用于制造终端消费产品、污水处理厂等。
- 纳米材料进入环境的重要问题:
- 生物降解、生物利用性、生物富集。
- 一些细菌和活细胞可摄入纳米颗粒,并在食物链中生物蓄积。食物链底端的水生生物可以以纳米颗粒物为食。
- 纳米材料在环境中的降解速率太低,可能会进入生物体中。
- 一些纳米材料被设计为环境中的化学反应物,其化学转化可能会增强或抑制材料的毒性。
- 纳米材料转化为毒性更强物质的潜力。
- 纳米材料和其它环境污染物的可能的相互作用。
- 目前的环境转化传输模型对于纳米材料的适用性。
- 生物降解、生物利用性、生物富集。
- 材料的生物毒性:氧化应激性、自噬作用、炎症反应、基因毒性。












