1 合成路线设计的基本原则与方法
- 逆向合成分析法:目标分子 $\Rightarrow$ 中间体 $\cdots$ 中间体 $\Rightarrow$ 起始原料。
- 主要手段:官能团转换、碳架变化。
- 合成子:分析过程中得到的分子碎片。分为d-合成子(带负电荷)、a-合成子(带正电荷)。
- 分析方法:分子简化法、官能团的转换和消去、拆解。
- 拆解:
- 如一个分子有明显的对称性,在考虑它的合成法时就应充分利用其对称性来简化合成方法。
- 在$\ce{\alpha-C}$的位置上拆开。
- 在共同碳原子处拆开。
- 拆解:
2 常用的官能团转换
- 双键:
- 与卤素加成:$\ce{>C=C< + X2 -> }$。反应机理:环状鎓离子。
- 与氢卤酸加成:$\ce{>C=C< + HX -> }$。反应机理:碳正离子机理。马尔科夫尼科夫规则。
- 形成醇:
- $\ce{R-CH=CH2 ->[H2O][H+] }$。反应机理:碳正离子机理。马尔科夫尼科夫规则。
- $\ce{R-CH=CH2 ->[BH3] ->[H2O2][OH-] RCHCH2OH}$。反应机理:四元环过渡态。反马尔科夫尼科夫规则。
- 三键:
- 还原成烯:
- $\ce{R-C#C-R’ ->[H2][Pd/BaSO4] }$。反应机理:异相催化。顺式加成。
- $\ce{R-C#C-R’ ->[Na][NH3] }$。反应机理:氨合电子。反式加成。
- 形成醛酮:
- $\ce{R-C#CH ->[H2O][Hg^2+] RCOCH3}$。反应机理:烯醇互变异构。
- $\ce{R-C#CH ->[B2H6] ->[H2O2][OH-] RCH2CHO}$。反应机理:烯醇互变异构。
- 端炔变非端炔:
- $\ce{R-C#C^-Na+ + R’CH2X -> R-C#C-CH2R’}$。反应机理:亲核取代。
- $\ce{R-C#C^-Na+ + R’_2C=O -> ->[H2O]}$。反应机理:亲核加成。
- 还原成烯:
- 羟基:
- 失水成烯:$\ce{->[H+][\triangle] RCH=C<}$。反应机理:碳正离子机理。扎依切夫规则。
- 形成卤代烷:
- $\ce{ROH + HX -> RX}$。反应机理:亲核取代。
- $\ce{ROH + PX3 -> RX + H3PO3}$。反应机理:亲核取代。
- $\ce{ROH + SOCl2 -> RCl + SO2 ^ + HCl ^}$。反应机理:形成无机酸酯后亲核取代。
- 氧化形成醛酮:
- $\ce{RCH2OH ->[CrO3/吡啶] RCHO}$。
- $\ce{RCHOHR’ ->[CrO3/吡啶] RCOR’}$。
- 羰基:
- 与亲核试剂加成:
- 含碳亲核试剂:$\ce{CN- -> \alpha}\text{-}$羟基酸、$\ce{-C#C^-Na+ -> \alpha}\text{-}$羟基炔、$\ce{RMgX -> }$醇、含磷内鎓盐$\ce{-> }$烯烃。
- 含氮亲核试剂:$\ce{NH2R -> ->[-H2O] }$亚胺、$\ce{NH2OH -> ->[-H2O] }$肟、$\ce{NH2NH2 -> ->[-H2O]}$、$\ce{NH2-NH-CO-NH2 -> ->[-H2O] }$羧基脲。
- 含氧亲核试剂:$\ce{ROH -> }$半缩醛(酮)、缩醛(酮)。
- 含硫亲核试剂:$\ce{RSH -> }$缩硫醛(酮)。
- 羰基$\ce{\alpha-H}$的反应:
- 卤代反应:$\ce{ + Br2 ->[酸或碱] }$$\ce{ + HBr}$。
- 卤仿反应:$\ce{RCOCH3 + X2 ->[NaOH] RCOONa + CHX3}$。反应机理:$\ce{\alpha-H}$卤代、加成-消除。
- 羟醛缩合:$\ce{2CH3COCH3 <=>[酸或碱] }$。反应机理:亲核加成。
- $\alpha, \beta\text{-}$不饱和醛酮的反应:$\ce{ + }$$\ce{->[CH3CH2ONa]}$$\ce{->[OH-]}$$\ce{->[H+]}$。
- 与亲核试剂加成:
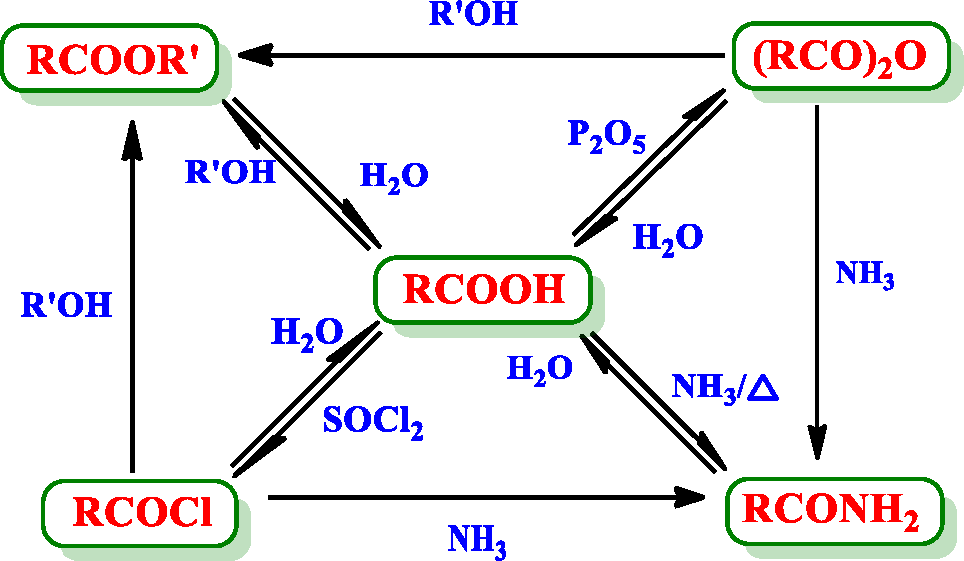
- 羧酸及其衍生物:
- 芳香族重氮盐:$\ce{Ph-NH2 ->[NaNO2, HCl][0 \text{~} 5^\circ C] Ph-N#NX}$。
- $\rm S_N1~\ce{Ar}$机理:与$\ce{H2O}$、$\ce{KI}$、$\ce{HS-}$、$\ce{SCN-}$。
- 自由基机理:与$\ce{CuCl}$、$\ce{CuBr}$、$\ce{CuCN}$、$\ce{H3PO2}$。其中$\ce{H3PO2}$将$\ce{-NH2}$还原为$\ce{-H}$。
3 碳架变化
- 碳链增长的反应:
- 金属有机化合物:
- 与卤代烷的偶联反应:$\ce{RMgX + R’X (}$活泼$\ce{) -> R’X}$。
- 与羰基的加成:
- $\ce{R-MgX + HCHO -> RCH2OMgX ->[H+][H2O] RCH2OH}$。
- $\ce{R-MgX + R’CHO -> R(R’)CHOMgX ->[H+][H2O] R(R’)CHOH}$。
- $\ce{R-MgX + R’COR’’ -> R(R’)(R’‘)OMgX ->[H+][H2O] R(R’)(R’‘)OH}$。
- $\ce{R-MgX + R’COOR’’ -> R’OR ->[R-MgX] ->[H+][H2O] R2(R’)COH}$。
- $\ce{R-MgX + R’COCl -> R’COR ->[R-MgX] ->[H+][H2O] R2(R’)COH}$。
- 与氰基反应:$\ce{R-MgX + R’CN -> R(R’)C=NMgX ->[H+][H2O] RCOR’}$。
- 与$\ce{CO2}$反应:$\ce{R-MgX + CO2 -> RCOOMgX ->[H+][H2O] RCOOH}$。
- 与环氧化合物的开环反应:$\ce{R-MgX +}$$\ce{-> RCH2CH2OMgX ->[H+][H2O] RCH2CH2OH}$。
- 碳负离子:炔烃、酮、酯、$\beta\text{-}$二羰基化合物}的烷基化、酰基化反应。
- 炔烃:(见上)
- 羰基$\ce{\alpha-C}$:
- 烷基化:$\ce{ + RCH2X -> }$。
- 酰基化:$\ce{ + RCOCl ->}$。
- 缩合反应:羟醛缩合、酯缩合、酮酯缩合。
- 醛酮:$\ce{ + }$$\ce{ -> }$。
- 迈可尔加成:$\ce{CH3(C=O)CH2(C=O)CH3 + CH2=CHCH=O <->[EtO-][EtOH] (CH3(C=O))2CH-CH2CH2CHO}$。
- 维蒂希反应:$+$$\ce{->}$。
- 芳环的烷基化和酰基化:
- 烷基化:$\ce{C6H6 + RCl ->[催化剂] Ph-R + HCl}$。
- 酰基化:$\ce{C6H6 + RCOCl ->[催化剂] }$$\ce{ + HCl}$。
- 金属有机化合物:
- 形成碳环的反应:
- 狄尔斯-阿尔德反应:$ + $$\ce{ <=> }$。
- 丙二酸酯与二卤代烷的烷基化反应:$\ce{CH2(COOC2H5)2 ->[^-B:]}$ $\ce{^-CH(COOC2H5)2 ->[X(CH2)_nX][\mathit{n} = 2, 3, 4]}$ $\ce{X(CH2)_n-CH(COOC2H5)2->[^-B:]}$
 。
。 - 狄克曼关环反应:
 。
。 - 分子内羟醛缩合反应;Robinson缩环反应:(见上)
- 缩短碳链的方法:
- 一元羧酸的脱羧反应:
- 一般的脱羧反应:$\ce{A-CH2-COOH ->[加热, 碱] A-CH3 + CO2}$。$\ce{A=COOH}$,$\ce{CN}$,$\ce{C=O}$,$\ce{NO2}$,$\ce{CX3}$,乙烯基等。
- $\ce{\alpha-C}$与不饱和键相连时:环状过渡态机理。$\ce{RCH=CHCH2COOH ->[\triangle] RCH2CH=CH2 + CO2}$。
- 酸性很强的羧酸:负离子机理。$\ce{Cl3CCOOH ->[H+][H2O] Cl3CCOO- ->[\triangle] Cl3C- + CO2}$。
- 汉斯狄克脱羧反应:$\ce{RCH2COOH ->[AgNO3, KOH] RCH2COOAg ->[Br2/CCl4] RCH2Br}$。
- 柯齐脱羧反应:$\ce{RCOOH ->[Pb(OAc)4] RCOOPb(OAc)3 ->[LiCl][C6H6, \triangle] RCl}$。
- 甲基酮的卤仿反应:$\ce{R(C=O)CH3 + 4NaOH + 3X2 -> RCOONa + CHX3}$。反应机理:加成消除机理。
- 霍夫曼降解反应:$\ce{RCONH2 + Br2 + NaOH -> RNH2 + CO2 + 2NaBr}$。
- 库尔提斯重排反应:$\ce{RCOCl + NaN3 -> R(C=O)N3 ->[\triangle][-N2] RN=C=O ->[H2O] RNH2 + CO2}$。
- 施密特重排反应:$\ce{RCOOH + HN3 ->[H2SO4][C6H6 \text{~} 50^\circ C] ->[\triangle] ->[H2O] RNH2 + CO2 + N2}$。
- 烯、炔、酮、芳烃侧链的氧化:$\ce{>C=C< ->[O3] ->[Zn, HOAC][H2O] >C=O + O=C<}$。
- 酯的高温裂解:$\ce{RCOOCH2CH2R’ ->[400 \text{~} 500^\circ C] RCOOH + CH2=CHR’}$。
- 一元羧酸的脱羧反应:
4 有机合成常用策略
- 在所需位置引入官能基:直接引入、官能基之间相互转换。
- 消去不必要的基团:
- 酮羰基还原为亚甲基:$\ce{RCOR’ ->[Zn-Hg/HCl][或 NH2NH2, OH-/(HOCH2CH2)2O] RCH2R’}$。
- 双键、三键还原为单键:$\ce{>C=C<, -C#C- ->[H2, Pt/Pd/Ni] >CH-CH<}$。
- 官能基保护:
- 醇羟基、羰基的保护:形成缩醛(酮)。
- 酚羟基、酚氨基的保护:酰基化。
- 封闭某些反应位置:苯的磺基化保护对位。
- 利用反应的选择性:
- 羧酸衍生物与金属有机化合物的反应活性不同:有机铜锂试剂与酰卤反应生成酮,与醛酮反应较慢,与其他衍生物不反应。
- 还原剂的选择性:$\ce{H2/Pt}$可加成孤立碳碳双键,$\ce{LiAlH4}$不可加成孤立碳碳双键。
5 有机反应的规则
- 马尔科夫尼科夫规则:$\ce{H}$原子加在含$\ce{H}$较多的$\ce{C}$上,$\ce{X}$原子加在含$\ce{H}$较少的$\ce{C}$上。
- 扎伊采夫规则:醇脱水或卤代烷脱卤化氢时,生成的产物中双键主要位于烷基取代基较多的位置。
- 顺反规则:醇脱水生成的烯烃有顺反异构体时,主要生成反式产物。
- 霍夫曼规则:四级铵碱加热分解生成烯烃时,生成的产物中双键主要位于烷基取代基较少的位置。
6 活性、稳定性比较
- 碳正离子:$3^\circ\ce{C} > 2^\circ\ce{C} > 1^\circ\ce{C}$。
- 有利于正电荷分散的给电子因素使碳正离子稳定。
- $3^\circ\ce{C}$相邻的烷基有给电子效应,且$\ce{C+}$的$\rm p$电子与相邻的$\ce{C-H}$键形成$\ce{\sigma-p}$超共轭。
- 苯甲型、烯丙型$\ce{C+}$的$\rm p$电子与$\pi$键形成$\ce{\mathrm{p}-\pi}$共轭。
-
碳负离子:$1^\circ\ce{C} > 2^\circ\ce{C} > 3^\circ\ce{C}$。
- 有利于负电荷分散的吸电子因素使碳负离子稳定。
- $\ce{N}$的碱性:
-
$ > $$ > $$ > $。
- 吡咯$\ce{N}$缺电子,碱性弱,有弱酸性;芳环富电子,与苯胺类似,亲电取代容易,邻位定位效应。
- 吡啶$\ce{N}$富电子,与三级胺类似,碱性强,易氧化;芳环缺电子,与硝基苯类似,亲电取代困难、间位定位效应、亲核取代容易。
- 芳香胺苯环邻对位上有给电子取代基时使碱性增强,间位有给电子取代基时使碱性减弱。苯环上有吸电子取代基时碱性减弱。
-
-
$\ce{\alpha-H}$的酸性:酰卤 > 酸酐 > 羧酸 > 酯 > 胺。
- 从左到右羰基的活性减小,$\ce{W}$的离去能力减小。
7 比较特殊的反应
- 氯甲基化反应:$\ce{C6H6 + HCHO + HCl(}$浓$\ce{) ->[ZnCl2, 60 ^\circ C] Ph-CH2Cl}$。
- 加特曼-科赫反应:$\ce{C6H6 + CO + HCl ->[AlCl3-CuCl] Ph-CHO}$。
- 卢卡斯试剂:$\ce{ROH + HCl(}$浓$\ce{) + ZnCl2(}$无水$\ce{) -> RCl v}$。$\ce{PhCH2OH} > 3^\circ\ce{ROH} > 2^\circ\ce{ROH} > 1^\circ\ce{ROH}$。
- 邻二醇被高碘酸($\ce{H5IO6}$)氧化:$\ce{RCH(OH)-CR2(OH) ->[H5IO6] RCHO + R2(C=O)}$。$\alpha\text{-}$羟基酮被氧化成酮(醛)和酸。
- 弗赖斯重排:$\ce{Ph-OOCR ->[AlCl3][\triangle] }$$+$。
- 克莱森重排:$\ce{PhOCH2CH=^14CH2 ->[200 ^\circ C]}$。
- 瑞穆尔-悌曼反应:$\ce{PhOH + CHCl3 ->[10~\%~NaOH.H2O][或 K2CO3/吡啶]}$$(主要) + 。
- 科尔贝-施密特反应:
- $\ce{PhONa + CO2 ->[125 \text{~} 150 ^\circ C][\pu{0.5 MPa}]}$。
- $\ce{PhOK + K2CO3 + CO2 ->[200 \text{~} 250 ^\circ C][\pu{0.5 MPa}]}$$\ce{ + HCOOK}$。
- 维蒂希反应:$+$$\ce{->}$。
- 卤仿反应:$\ce{RCOCH3 + X2 ->[NaOH] RCOONa + CHX3}$。
- 安息香缩合:$\ce{2Ph-CHO ->[CN-][C2H5OH, H2O]}$。
- 醛酮还原成亚甲基:
- 克莱门森还原:$\ce{->[Zn-Hg, 浓HCl][\triangle]}$,酸性条件下还原。
- 沃尔夫-凯惜纳-黄鸣龙还原:$\ce{->[NH2-NH2, NaOH][(HOCH2CH2)2O, \triangle]}$,碱性条件下还原。
- 缩硫醇氢解:$\ce{->[HS-CH2CH2-SH][H+] ->[H2/Ni]}$,中性条件下还原。
- 氧化醛的试剂:
- 托伦斯试剂(银氨溶液):甲醛、脂肪醛、芳香醛都反应。
- 斐林试剂:甲醛、脂肪醛反应,芳香醛不反应。
- 本内迪克特试剂:脂肪醛反应,甲醛、芳香醛不反应。
- 坎尼扎罗反应:$\ce{Ph-CHO + HCHO ->[NaOH] Ph-CH2OH + HCOONa}$。
- 迈克尔加成:$\ce{CH3(C=O)CH2(C=O)CH3 + CH2=CHCH=O <->[EtO-][EtOH] (CH3(C=O))2CH-CH2CH2CHO}$。
- 罗宾逊成环反应:$\ce{ + CH2=CH(C=O)CH3 ->[OH-][\triangle] }$$\ce{->[H2O]}$。
- 赫尔-乌尔哈-泽林斯基反应:$\ce{RCH2COOH + Br2 ->[PBr3][-HBr] RCHBrCOOH}$。
- 汉斯狄克脱羧反应:$\ce{RCH2COOH ->[AgNO3, KOH] RCH2COOAg ->[Br2/CCl4] RCH2Br}$。
- 柯齐脱羧反应:$\ce{RCOOH ->[Pb(OAc)4] RCOOPb(OAc)3 ->[LiCl][C6H6, \triangle] RCl}$。
- 酯的高温裂解:$\ce{RCOOCH2CH2R’ ->[400 \text{~} 500^\circ C] RCOOH + CH2=CHR’}$。
- 霍夫曼降解反应:$\ce{RCONH2 + Br2 + NaOH -> RNH2 + CO2 + 2NaBr}$。
- 盖布瑞尔伯胺合成反应:$\ce{->[KOH][C2H5OH]}$$\ce{->[RX][THF 或 DMF]}$$\ce{->[H+ 或 OH-][H2O 或 ROH]}$$\ce{+ RNH2}$。
- 柯普消除反应:$\ce{->[\triangle]}$$\ce{+ R2N-OH}$。
- 霍夫曼消除:$\ce{[CH3CH2N^+(CH3)3]OH- ->[100 \text{~} 200^\circ C] CH2=CH2 + (CH3)3N + H2O}$。
- 库尔提斯重排反应:$\ce{RCOCl + NaN3 -> R(C=O)N3 ->[\triangle][-N2] RN=C=O ->[H2O] RNH2 + CO2}$。
- 施密特重排反应:$\ce{RCOOH + HN3 ->[H2SO4][C6H6 \text{~} 50^\circ C] ->[\triangle] ->[H2O] RNH2 + CO2 + N2}$。