说明
本资料原本打算整理出所有可能的重点,但是经过期末考试之后,本人发现了内容的盲区,因此请不要以此资料为复习重点。期待2020年选课的朋友补充添加内容。
正文
- 环境纳米实验室研究内容:
- 环境功能材料的开发、合成与表征。
- 功能材料环境应用。
- 材料水环境行为和毒理。
- 纳米科技:在纳米尺度(1 ~ 100 nm)上研究物质的特性和相互作用,以及利用这些特性的科学和技术。
- 纳米材料:三维空间中至少有一维处于纳米尺度。按电子运动的纬度分为四类:
- 零维(0D):纳米颗粒、纳米团簇等。
- 一维(1D):钛纳米管、碳纳米管等。
- 二维(2D):石墨烯、g-C3N4。
- 三维(3D):介孔棒术、分级微球等。
- 重要纳米材料:钛系、碳系、常规金属系、有机高分子系。
- 纳米效应:
- 量子尺寸效应:金属费米能级在小尺寸下由准连续变为分立能级。
- 小尺寸效应:超细微粒的尺寸在声、光、电、磁、热、力学等特性改变。
- 表面效应:纳米粒子比表面积、表面能增加,表面原子呈现不饱和性质,化学活性高。
- 宏观量子隧道效应:微观粒子具有贯穿势垒的能力(应用于扫描隧道显微镜STM)。
- 纳米技术的研究:
- 聚焦(从上而下):材料尺寸从大尺度变小。
- 放大(从下而上):以原子分子为基本单元设计微观材料。
- 纳米材料制备方法:
- 物理方法:
- 机械粉碎法:固体物料离子尺寸由大变小,包括破碎和粉磨。
- 物理气相沉积法:主要过程是固体材料的蒸发和蒸发蒸气的冷凝或沉积。
- 化学方法:
- 化学气相沉积法:通过化学反应使反应产物蒸气形成过饱和蒸气压,凝聚形成大量晶核并聚集成颗粒。
- 化学沉淀法:一种或多种离子的可溶性盐溶液,加入沉淀剂或于一定温度下水解,形成不溶氢氧化物或盐析出。
- 水热法:高温高压下在水或蒸汽等流体中进行化学反应,可使通常难熔或不溶的物质溶解,并可以重结晶。
- 物化方法:
- 溶胶-凝胶法:金属醇盐或无机盐水解,然后使溶质聚合凝胶化,再将凝胶干燥煅烧得到。
- 微乳液法:采用两种互不相溶的液相,一相以微液滴形式分散在另一相中所形成的的分散体系。
- 模板法:具有纳米结构、形状容易控制、价廉易得的物质作为模板,以物理或化学方法将材料沉积到模板的孔中或表面后移去模板得到具有模板形貌与尺寸的材料。
- 物理方法:
- 纳米材料中的键合:金属键、离子键、共价键、分子键(范德华力)、氢键等。
- 晶体结构:7大晶系,14种布拉维点阵。结构参数包括结点、晶向指数[uvw]、晶面指数(hkl)。
- 纳米材料的表征内容:成分分析、形貌分析、粒度分析、结构分析、表面界面分析等。
- 材料分析方法:
- 透射电子显微镜(TEM):电子束打穿成像。可以观察材料内部形态。电子束能量高,不要求导电性。
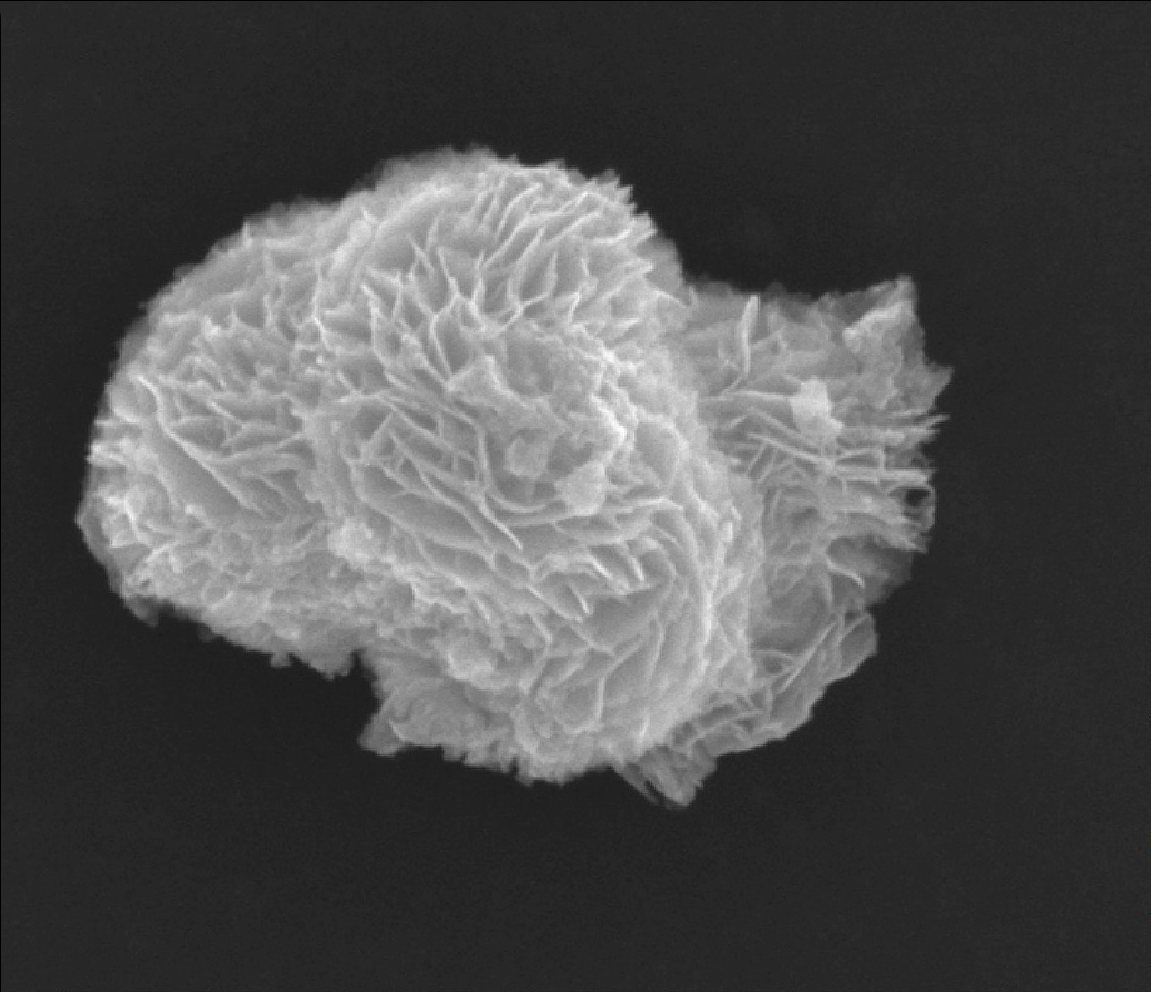
- 扫描电子显微镜(SEM):聚焦电子束在表面逐点扫描显示样品表面各种特征,研究材料的表面化学结构和电子状态。只能观察导体或半导体,绝缘体需要喷镀导电层。
- 原子力显微镜(AFM):类似扫描电子显微镜,利用针尖与样品间的相互作用力产生的形变,可研究绝缘体的表面形貌。
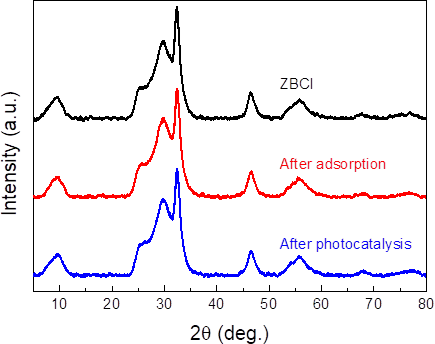
- X射线衍射(XRD):物相分析。横轴为2θ,纵轴为强度。原理是散射波发生干涉,满足布拉格方程,\(2d\sin \theta = n \lambda\)。用于研究晶面信息。定性分析需要粉末衍射卡(PDF卡),利用字母索引找出物质的三强线(三条最强线定物质)。定量分析只能确定具体比例关系。
- X射线光电子能谱(XPS):元素组成分析。横轴为结合能(Binding Energy),纵轴为强度。表面分析技术,表征材料表面元素及其化学状态。原理是光电效应。对于激发出来的光电子依据激发轨道的名称进行标记,一般只要某元素存在所有强峰都存在。主要用于氧化态识别。
- 红外吸收光谱(IR):官能团分析。横轴为波数(一般为4000 ~ 400),纵轴为透射率,峰为倒峰。先理论计算,查标准谱图数据,根据文献获得分子或基团的振动频率,与试验结果对照确定某些分子或基团的存在。O-H、N-H、C-H伸缩振动区在4000 ~ 2500 cm-1,其中O-H在3650 ~ 3200 cm-1,醇、酚、酸等。红外光谱主要观察有机官能团,拉曼光谱可观察无机官能团。
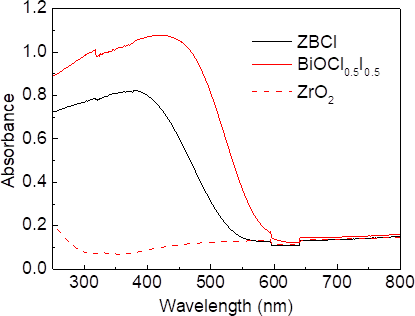
- 紫外可见漫反射(UV-vis DRS):能间带分析。原理是固体表面对光的漫反射,吸收光谱波长分布是由于产生谱带的跃迁能级间的能量差决定的。若在250 ~ 300 nm处有中等强度吸收峰,可能含苯环。
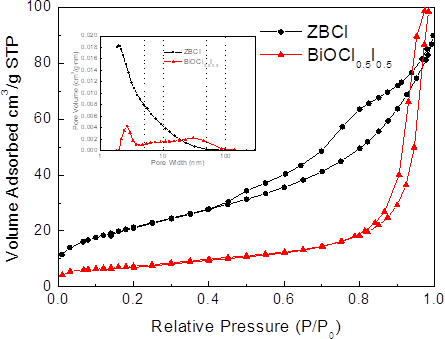
- 比表面(BET)和孔隙度(BJH)分析:单位质量物质的总表面积,通过测定不同压力下的吸附量获得等温吸附线,按公式推断比表面积、孔容积和孔径分布。
- 粒径与表面电荷分析:原理是使用动态光散射测定粒子布朗运动,根据电泳速度、电场强度、黏度、介电常数计算Zeta电位。可根据不同pH下的Zeta电位得到零电势点(pHpzc)。
- 激光拉曼光谱法:分子振动光谱,基于拉曼散射效应,对于入射光频率不同的散射光谱分析,得到分子振动、转动信息,用于分子结构研究。
- 热分析技术:在程序控制温度下测量物质物理性质随温度变化的函数关系,差热分析(DTA)、差式扫描量热法(DSC)、热重分析(TGA)。
- 吸附的基本原理:两相体系组成在相界面和相内部不同,在相界面产生积蓄,本质是物质的相分配。分为物理吸附和化学吸附。
- 吸附平衡:一定条件下足够长时间后吸附质在两相浓度不变,达到吸附平衡。对指定吸附剂和吸附质,吸附量大小由温度和平衡时气体压强或溶质浓度决定。
- 吸附机理:吸附质从流体主体通过扩散穿过薄膜或边界层传递到吸附剂外表面(内扩散),通过孔扩散从外表面传递到内表面(内扩散),吸附质沿孔表面扩散(表面扩散),吸附质被吸附在孔表面上。多数情况下内扩散慢(内扩散控制),少数情况下反之(外扩散控制)。
- 动力学与热力学:
- 热力学判断反应能否发生,热力学判断反应的速率与程度。
- \(K = \exp \left ( - \cfrac {\Delta G ^ \ominus} {RT} \right )\),\(k = A \exp \left( - \cfrac {E_{\mathrm a}} {RT} \right )\)。
- 吸附动力学:
- 准一级动力学:吸附质从溶液中到达吸附剂表面受扩散步骤控制,吸附剂表面只有一种结合位点。\(\cfrac {\mathrm dq}{\mathrm dt} = k_1(q_e - q)\),边界条件\(t = 0\),\(q = 0\),得到:\(\ln (q_e - q) = \ln q_e - k_1t\),其中\(q_e\)为平衡吸附量。以\(t\)为横轴,\(\ln(q_e - q_t)\)为纵轴作图,如果能得到一条直线,说明其吸附机理符合准一级动力学模型。具有局限性,常常只是和吸附初始阶段。
- 准二级动力学:假定吸附速率受化学吸附机理控制,涉及吸附质与吸附剂之间电子对公用或转移,吸附剂表面有两种结合位点。\(\cfrac {\mathrm dq}{\mathrm dt} = k_2(q_e - q)^2\),边界条件\(t = 0\),\(q = 0\),得到:\(\cfrac {t}{q_t} = \cfrac {1}{k_2q_e^2} + \cfrac {t}{q_e}\)。以\(t\)为横轴,\(t / q_t\)为纵轴作图,斜率为\(1 / q_e\)。几乎所有吸附过程都满足准二级动力学模型。
- 吸附等温线:\(q_{\mathrm e} = \cfrac {V(c_0 - c_{\mathrm e})}{w}\)。
- 在温度一定的条件下,如\(V\)、\(c_0\)一定,改变吸附剂的投加量或者吸附质的初始浓度\(c_0\),则水中剩余吸附质浓度\(c_e\)及\(q_e\)也随之改变。吸附量与剩余浓度不是线性关系。
- IV类吸附等温线存在迟滞回环,吸附和解吸附曲线不完全重合,表明材料是介孔材料。可以认为是由于产生毛细管凝结现象所致。
- 吸附等温式:
- 朗缪尔方程:\(q = \cfrac {k_1q_{\mathrm m}p}{1 + k_1p}\),变换为\(\cfrac {1}{q} = \cfrac {1}{k_1 q_{\mathrm m}} \cdot \cfrac{1}{p} + \cfrac {1}{q_{\mathrm m}}\)。以\(1/p\)为横轴,\(1/q\)为纵轴作图。与朗缪尔方程完全吻合的物系相当少,但有大量的物系近似符合。该模型在低浓度范围就简化为亨利定律。
- 弗兰德里希方程:\(q = kp^{1/n}\),取对数\(\lg q = \lg k + \cfrac {1}{n}\lg p\)。以\(\lg p\)为横轴,\(\lg q\)为纵轴作图。当n = 1时,转化为线性吸附方程。经验公式,不但适用于气体吸附,也适用于液体吸附,气体吸附压力范围不能太宽,低压高压区域拟合效果不好。
- 液相吸附平衡:比气相复杂,溶剂和溶液都有可能被吸附,在溶剂的吸附作用忽略不计时可以认为是单组分吸附。
- 吸附影响因素:吸附剂(比表面积、孔结构、表面化学性质等)、吸附质(溶解度、极性、分子量、溶质浓度、金属离子兴塔等)、操作条件(接触时间、温度、pH、共存物质)等。
- 金属有机骨架化合物(MOFs):
- 由无机金属中心(金属离子或金属簇)与桥连的有机配体通过自组装相互连接,形成的一类具有周期性网络结构的晶态多孔材料。
- 组成:无机金属中心、桥状有机配体、自组装、晶状多孔材料。
- 形成的四要素:金属的活性、有机配体的灵活性、官能团的选择性、特殊的空间结构。
- 应用:气体储存、催化剂、分离、光电磁材料等。
- 光催化:半导体在紫外和可见光下,将污染物降解或矿化成环境无害产物,或将光能转化为化学能的过程。
- 半导体能带:半导体最高充满电子的满带称为价带,最低无电子的空带称为导带,价带和导带之间称为禁带。用能量大于等于禁带宽度的光照射时,价带电子激发跃迁到导带,在价带产生空穴。
- 价带空穴是强氧化剂,而导带电子是强还原剂。
- 空穴与H2O或OH-结合产生·OH,电子与O2结合产生·O2-、·OH等。
- 空穴和自由基的强氧化性可氧化有机物,导带的强还原性可还原重金属。
- 鉴定自由基或空穴作用:自由基淬灭实验(用淬灭剂与自由基反应,测定自由基的效果)、电子自旋谐振(ESR,测定是否有自由基生成)。
- 光催化反应动力学方程:L-H模型。\(- \cfrac {\mathrm dc}{\mathrm dt} = r = k \cfrac {Kc}{1 + Kc}\)。\(Kc \gg 1\)时简化为零级反应方程,积分得到\(c_0 - c = k_0t\)。\(Kc \ll 1\)时简化为一级反应方程,积分得到\(\ln (c_0 / c_t) = k_1t\)。
- 光催化影响因素:催化剂(禁带宽度、表面状态等)、操作条件(pH、温度、反应物初始浓度等)、反应设备(间歇式/连续式)等。
- 常用光催化剂:TiO2。常用溶胶-凝胶法合成。
- 三种结构和晶形:金红石、锐钛矿、板钛矿。
- 锐钛矿活性高,原因:禁带宽度高、表面吸附能量、结晶尺寸小、表面积大。
- 活性影响因素:晶体结构(各晶形比例)、催化剂颗粒直径、pH等。
- 提高光催化活性途径:贵金属沉积(形成微电池促进光生电子和空穴分离)、半导体复合构建异质结(不同半导体导带和价带分别相连,促进光生电子和空穴分离)、离子掺杂修饰(形成捕获中心和掺杂能级,出现晶格缺陷,导致载流子长度增大)、表面光敏化(使光催化吸收波长红移至可见光范围)等。
- g-C3N4:非金属聚合物半导体,新型可见光光催化剂。在众多方面具有广阔的应用前景,不足之处在于光催化效率不如TiO2。
- 催化:靠用量极少而本身不被消耗的一种叫做催化剂的外加物质来加速化学反应的现象。
- 准则:只加速热力学可行的反应,只改变反应速度不改变平衡位置,平衡体系对正逆反应速率同比例加速,可以控制反应方向、具有选择性,可以改变反应历程,降低活化能。
- 类型:均相催化、非均相催化、酶催化。
- 固体催化剂组分:活性组分(主催化剂,核心,常用金属、金属氧化物和硫化物、盐类或酸性催化剂)、助催化剂(助剂、结构性和调变性,本身无催化活性,加入后提高催化剂的性能)、载体(兼做稳定剂和分散剂,常用“活性组分/载体”的写法表示)。
- 纳米材料催化性能:纳米效应、小尺寸(单原子催化)、晶面结构。
- SO4·-高级氧化技术:
- 优势:中性条件下标准还原电位更高,酸性条件下对目标污染物选择性更强,具有更长的半衰期。
- 前驱体:单过硫酸氢钾(PMS,KHSO5),过硫酸盐(PS,S2O82-)。
- PMS激发机理:单过硫酸氢盐产生[O]、羟基自由基、硫酸根自由基。起始阶段单过硫酸氢盐经光、热、催化等方式激发后产生硫酸根自由基,传播阶段发生自由基链式反应,终止阶段自由基淬灭、链式反应终止。
- PMS活化方式:过渡金属活化,Co2+被认为是活化性能最好的过渡金属离子。
- 膜技术:分离两相,选择性传递物质。分离溶质一般称为渗析,分离溶剂一般称为渗透。
- 膜分离特点:一般温度下即可操作,无相变,浓缩分离同时进行,不需要投加其他物质,不改变分离物质的性质,适应性强。
- 纳滤(NF):介于反渗透和超滤之间,低压反渗透/疏松反渗透。
- 截流相对分子质量200 ~ 2000的物质,膜孔径1 ~ 2 nm左右。有效截流二价及高价离子和有机小分子,使大部分一价无机盐透过,可分离氨基酸和蛋白质,实现高分子和低分子有机物分离。
- 原理:以压力差为驱动力,存在纳米级为空,大部分负荷电,对无机盐的分离受化学式和电势梯度的影响。
- 应用:单价盐不需要有较高的脱除率,分离不同价态的离子,分离高分子量与低分子量的有机物。如饮用水制备。
- 反渗透(RO):以高于渗透压的压力差为推动力,从溶液中分离出溶剂的膜分离操作。和自然渗透的方向相反。分离对象是溶质、小分子物质。
- 应用:超纯水、饮用水、废水回用、纯水、水的精制、浓缩分离。
- 材料的生物毒性:氧化应激性、自噬作用、炎症反应、基因毒性。
 |
 |
 |
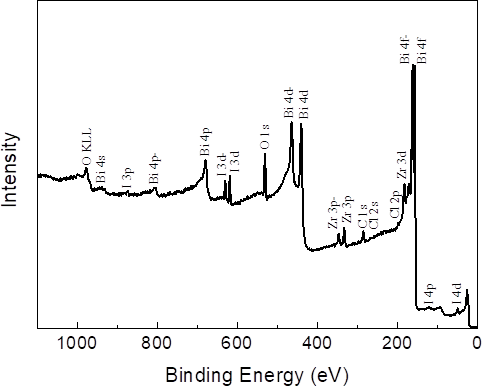 |
 |
 |
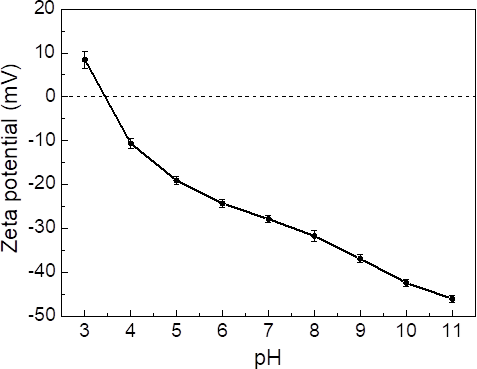 |